题目内容
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是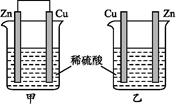
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
C
解析试题分析:对于甲形成了Cu、Zn原电池。由于Zn的活动性比Cu强,所以Zn为原电池的负极,Cu为原电池的正极,在负极发生反应:Zn-2e-=Zn2+;在正极上发生反应:2H++2e-= H2↑。因此在Cu上有气泡产生。由于H+不断消耗,所以溶液的酸性逐渐减弱。在乙中,只有Zn与硫酸发生,,没有形成原电池,在Zn上有气泡。因为硫酸发生反应,所以溶液的酸性逐渐减弱。因为在甲中形成了原电池,而在乙中没有形成原电池,所以产生气泡的速率甲比乙快。故正确选项是C。
考点:考查Zn、Cu在硫酸溶液中发生反应的现象及原理的知识。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中正确的是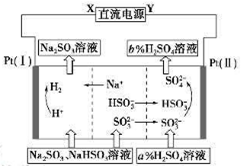
| A.X为直流电源的正极,Y为直流电源的负极 |
| B.阳极区pH减小 |
| C.图中的b<a |
| D.阴极的电极反应为HSO3——2e—+H2O=SO42—+3H+和 SO32——2e—+2H2O=SO42—+4H+ |
下列关于实验现象的描述不正确的是 ( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
图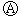 为直流电源,
为直流电源,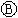 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,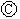 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )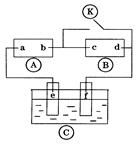
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生氧化反应 |
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是 ( )
| A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的化学式为HgNO3 |
| D.硝酸亚汞的化学式为Hg2(NO3)2 |
下列有关四个电化学装置的叙述正确的是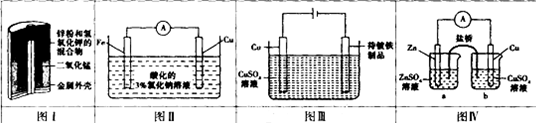
| A.图I装置中MnO2作催化剂 |
| B.图II装置工作一段时间后,滴加少量K3[Fe(CN)6]溶液,无明显现象 |
| C.图III装置中Cu作阳极,为电解液提供Cu2+,保持溶液中Cu2+浓度恒定 |
| D.图IV装置工作时,为平衡电荷,a烧杯中的Zn2+经盐桥移向b烧杯中 |
镍氢电池的总反应为 H2+2NiO(OH) 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
| A.NiO(OH) | B.Ni(OH)2 |
| C.H2 | D.H2和NiO(OH) |
右图为铜锌原电池示意图,下列说法错误的是( )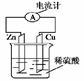
| A.锌片为负极,且逐渐溶解 |
| B.铜片为正极,铜不易失电子而受到保护 |
| C.电子由锌片通过导线流向铜片,H+往铜片运动 |
| D.该装置能将电能转变为化学能 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是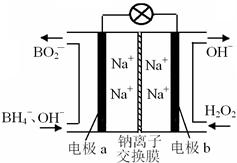
| A.电池放电时Na+从b极区移向a极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
| C.该电池的负极反应为:BH4-+ 8OH-+8e-→BO2-+ 6H2O |
| D.每消耗3 mol H2O2,转移的电子为3 mol |