题目内容
图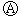 为直流电源,
为直流电源,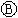 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,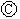 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现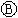 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )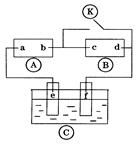
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生氧化反应 |
D
解析试题分析:A.接通电路后发现 上的c点显红色.说明在c点H+放电,使c(OH-)的浓度增大,溶液显碱性。因此c电极为阴极,则b为负极,a为正极;错误。B.c与电源的负极连接,c为阴极,d为阳极。在d极发生的反应为2Cl--2e-=Cl2↑.错误。C.由于
上的c点显红色.说明在c点H+放电,使c(OH-)的浓度增大,溶液显碱性。因此c电极为阴极,则b为负极,a为正极;错误。B.c与电源的负极连接,c为阴极,d为阳极。在d极发生的反应为2Cl--2e-=Cl2↑.错误。C.由于 为电镀槽,由于e与电池的正极连接,所以e为阳极,f为阴极。为实现铁上镀锌,阳极e为Zn,阴极f为Fe板。错误。D.e极是阳极,失去电子,发生氧化反应。正确。
为电镀槽,由于e与电池的正极连接,所以e为阳极,f为阴极。为实现铁上镀锌,阳极e为Zn,阴极f为Fe板。错误。D.e极是阳极,失去电子,发生氧化反应。正确。
考点:考查原电池、电解池的确定、电极反应、电极材料等知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法不正确的是
| A.光催化还原水制氢比电解水制氢更节能环保、更经济 |
| B.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 |
| C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol·L-1的目标分子 |
| D.向汽油中添加甲醇后,该混合燃料的热值不变 |
下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
下列描述中,不符合生产实际的是 ( )
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 | B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | D.在镀件上电镀锌,用锌作阳极 |
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是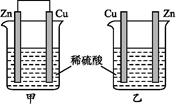
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是( )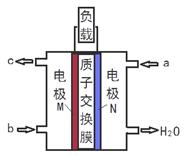
| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
| A.电池工作时H+ 移向负极 |
| B.该电池用的电解质溶液是KOH溶液 |
| C.甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+ |
| D.电池工作时,理论每有净化1mol CO(NH2 )2,消耗 33.6 L O2 |
