题目内容
右图为铜锌原电池示意图,下列说法错误的是( )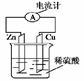
| A.锌片为负极,且逐渐溶解 |
| B.铜片为正极,铜不易失电子而受到保护 |
| C.电子由锌片通过导线流向铜片,H+往铜片运动 |
| D.该装置能将电能转变为化学能 |
D
解析试题分析:A.该图为铜锌原电池示意图,由于金属活动性Zn>Cu。所以Zn为原电池的负极,发生反应:Zn-2e-Zn2+,逐渐溶解。正确。B.铜片为正极,在正极上发生反应:2H++2e-=H2↑。铜没有参加反应,不失电子而受到保护。正确。C.在原电池中电子由负极锌片通过导线流向正极铜片,在溶液中根据同种电荷相互排斥,异种电荷相互吸引的原则,H+往负电荷较多的正极铜片运动。正确。D.该装置能将化学能转变为 电能。错误。
考点:考查原电池的化学反应原理及应用的知识。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是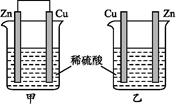
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗6molH2O2转移电子6mol |
| C.电极a采用MnO2,MnO2既作电极又有催化作用 |
| D.该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+ |
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质。图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛。下列说法不正确的是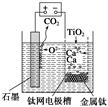
| A.阳极反应式为C + 2O2- - 4e-=CO2↑ |
| B.由TiO2制得1mol 金属Ti ,理论上外电路转移4 mol电子 |
| C.制备金属钛前后,装置中CaO的量不变 |
| D.TiO2在阴极放电 |
银锌纽扣电池的总反应式为Zn+Ag2O+H2O = Zn(OH)2+2Ag,下列说法不正确的是( )
| A.锌做负极 | B.放电时,正极产物是银 |
| C.电解质溶液不可能呈酸性 | D.充电时发生了原电池反应 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关的判断正确的是
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(Na+)=0.2 mol·L-1 |
| B.电解后溶液中c(H+)=0.2 mol·L-1 |
| C.上述电解过程中共转移0.4 mol电子 |
| D.电解后得到的Cu的物质的量为0.1 mol |
