题目内容
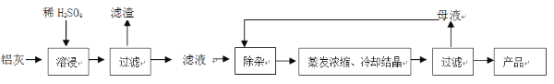
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
【答案】Al2O3+6H+=2Al3++3H2O 取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色 将Fe2+氧化为Fe3+ 调节pH值使铁完全沉淀 有黄绿色气体生成 MnO2+4HCl![]() MnCl2+ Cl2↑+2H2O 除去过量的
MnCl2+ Cl2↑+2H2O 除去过量的![]() K2SO4
K2SO4
【解析】
根据工艺流程分析可知,铝灰加稀硫酸酸浸后,Al2O3和铁的氧化物溶解,过滤得到SiO2的滤渣和含有Al3+、Fe3+、Fe2+的滤液,除杂后冷却结晶再过滤,得到产品,据此分析解答问题。
(1)硫酸溶解氧化铝的离子方程是属于基础题,该离子方程式为A12O3+6H+=2A13++3H2O;
(2)由于在上述流程中,所得的滤液既含有亚铁离子,又含有铁离子,因此二者共存时要检验亚铁离子应该用酸性高锰酸钾溶液检验,避免使用KSCN;所以操作方法为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色;
(3)①除杂步骤中加入高锰酸钾就是要加入氧化剂,把亚铁离子氧化为铁离子,在调节pH值到3.2,好让铁离子完全沉淀除去,同时不使其他离子沉淀;
②若步骤II所得的沉淀中含有二氧化锰,则往沉淀中加入浓盐酸,则会发生我们熟悉的实验室制备氯气的反应,因此可以观察到有黄绿色气体产生,方程式为MnO2+4HCl= MnCl2+Cl2↑+2H2O;
③步骤II所得的上层溶液显紫红色,所以溶液中含有![]() ,
,![]() 可与Mn2+反应生成MnO2 ,所以加入MnSO4的目的是出去过量的
可与Mn2+反应生成MnO2 ,所以加入MnSO4的目的是出去过量的![]() ;
;
(4)除杂步骤除去了杂质离子,不断循环后,循环液中含有大量的高锰酸钾反应剩下的钾离子,同时加入了MnSO4,所以还剩有硫酸根离子;因此主要物质是硫酸钾。



