题目内容
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下:
![]()
已知“还原”反应中,冰钢中的![]() 先转化为
先转化为![]() ,然后
,然后![]() 再与
再与![]() 反应生成粗铜。下列叙述正确的是( )
反应生成粗铜。下列叙述正确的是( )
A.该炼铜工艺对环境友好,不会产生大气污染物
B.“焙烧”过程中,![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂
C.在![]() ”还原”为Cu的总反应中,
”还原”为Cu的总反应中,![]() 作催化剂
作催化剂
D.“电解”时,金、银等贵金属被置换出来形成阳极泥
【答案】B
【解析】
A、火法粗炼涉及反应![]() ,
,![]() ,
,![]() 等,各个反应均会生成有污染性的气体
等,各个反应均会生成有污染性的气体![]() ,故A错误;
,故A错误;
B、焙烧反应为![]() ,其中Fe的化合价由
,其中Fe的化合价由![]() ,S的化合价由
,S的化合价由![]() ,Cu的化合价由
,Cu的化合价由![]() ,所以
,所以![]() 既是氧化剂又是还原剂,故B正确;
既是氧化剂又是还原剂,故B正确;
C、![]() ”还原”为Cu的总反应是
”还原”为Cu的总反应是![]() ,
,![]() 是反应物、并且是氧化剂,不是催化剂,故C错误;
是反应物、并且是氧化剂,不是催化剂,故C错误;
D、阳极泥是不参与阳极反应的金属沉积下来形成的,金、银等不活泼金属在阳极沉积成阳极泥,故D错误;
故选:B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
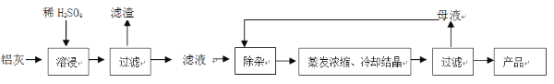
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D