题目内容
【题目】有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题. 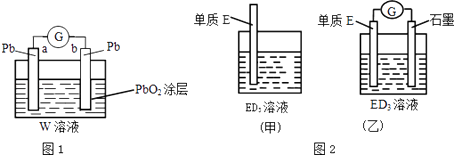
(1)A2B的结构式为 .
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示). 在b电极上发生的反应可表示为:PbO2+4H++SO42﹣+2e﹣=PbSO4+2H2O,则在a电极上发生的反应可表示为 . 电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g/cm3)变为mol/L.(小数点后保留两位)
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为 .
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,单质E一极发生的反应可以表示为
【答案】
(1)H﹣O﹣H
(2)Pb﹣2e﹣+SO42﹣=PbSO4;5.07
(3)Fe+2Fe3+=3Fe2+
(4)Fe﹣2e﹣=Fe2+
【解析】解:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2 , A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3 , 则C为S元素,D应为Cl元素.(1)A2B2为H2O,为共价化合物,结构式为H﹣O﹣H, 所以答案是:H﹣O﹣H;(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4 , 形成铅蓄电池,负极反应为Pb﹣2e﹣+SO42﹣=PbSO4 , 反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4 , 已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)= ![]() =5.17mol,所以剩余的n(H2SO4)=5.07mol,则浓度为5.07mol/L,
=5.17mol,所以剩余的n(H2SO4)=5.07mol,则浓度为5.07mol/L,
所以答案是:Pb﹣2e﹣+SO42﹣=PbSO4;5.07;(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+ , 溶液由黄色逐渐变为浅绿色,
所以答案是:Fe+2Fe3+=3Fe2+;(4)石墨﹣﹣铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe﹣2e﹣=Fe2+ ,
所以答案是:Fe﹣2e﹣=Fe2+ .

 阅读快车系列答案
阅读快车系列答案