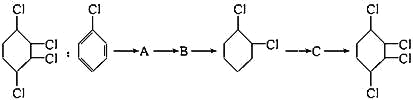
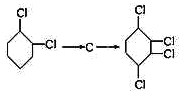
��Ŀ����
����Ŀ����֪���� Cl2ͨ������ NaOH ��Һ�������п����� NaCl��NaClO��NaClO3���� ��ֵ�����¶ȸߵ��йء���n(NaOH)=6a mol ʱ�������й�˵������ȷ����
��ֵ�����¶ȸߵ��йء���n(NaOH)=6a mol ʱ�������й�˵������ȷ����
A.�μӷ�Ӧ�����������ʵ��� 3amol
B.�ı��¶ȣ�������NaCl ����С���۲���Ϊ 3a mol
C.�ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ��� n �ķ�Χ��3a mol��n��5a mol
D.ij�¶��£���Ӧ�� ������Һ��
������Һ��
���𰸡�D
��������
2NaOH �� Cl2 = NaClO ��NaCl �� H2O��6NaOH ��3Cl2 = NaClO3 ��5NaCl ��3H2O
A. ���ݷ���ʽ��ϵ����gaunt�����ĸ���Ӧn(Cl2):n(NaOH) = 1:2����n(NaOH)=6a mol ʱ���μӷ�Ӧ�����������ʵ��� 3amol����A��ȷ��
B. �ı��¶ȣ���������1����Ӧ��������NaCl����С���۲���Ϊ 3a mol����B��ȷ��
C. �ı��¶ȣ���ֻ������1����Ӧʱ��ת��3amol���ӣ���ֻ������2����Ӧʱ��ת��5amol���ӣ���˷�Ӧ��ת�Ƶ��ӵ����ʵ��� n �ķ�Χ��3a mol��n��5a mol����C��ȷ��
D. ij�¶��£���Ӧ��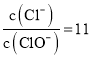 ������c(Cl��)=11 mol��L1����Ϊc(ClO��)=1 mol��L1�����ݷ���ʽ��c(Cl��)=1 mol��L1�Ƿ�����1����Ӧ�õ�������c(Cl��)=10 mol��L1�Ƿ�����2����Ӧ�õ�����˸��ݹ�ϵ�õ�����c(ClO3��)=2 mol��L1�������Һ����
������c(Cl��)=11 mol��L1����Ϊc(ClO��)=1 mol��L1�����ݷ���ʽ��c(Cl��)=1 mol��L1�Ƿ�����1����Ӧ�õ�������c(Cl��)=10 mol��L1�Ƿ�����2����Ӧ�õ�����˸��ݹ�ϵ�õ�����c(ClO3��)=2 mol��L1�������Һ���� ����D����
����D����
������������ΪD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����������Ҫ�������������Բ��ϡ��������ϡ���ѧ�����������Ϳ�ϵȡ���ҵ��ͨ�����¹����������ƿ�ʯ��Y2 FeBe2 Si2O10,Y�Ļ��ϼ�Ϊ+3����ȡ�����ơ�
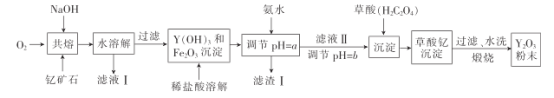
��֪:i.���������Ԫ�����ڱ��ĶԽ���λ��,��ѧ��������;
ii.Fe3+��Y3+�γ������������ʱ��pH���±�:
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
��1�������������ʽ��ʾY2 FeBe2 Si2O10Ϊ___, �ƿ�ʯ������ǰҪ���飬Ŀ����___��
��2������ʱͨ��������������_________��
��3����ҺI�����ʵ���Ҫ�ɷ���___ �� �����ƿ�ʯǡ����NaOH��ȫ��Ӧ����
��4���ð�ˮ����pH=aʱ,a��ȡֵ��Χ��_____,���ʵ��֤������I������ȫ: _______________��
��5�����ղ�����ʱ�����ֽⷴӦ,��������Ϊ������,���������ʹ����ʯ��ˮ����ǡ�д��������[Y2(C2O4)3��nH2O]���յĻ�ѧ����ʽ:_____________��