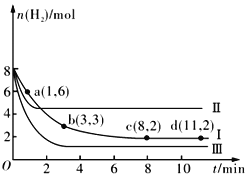
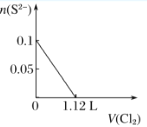
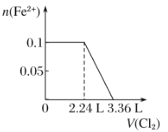
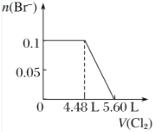
题目内容
【题目】如图是铝热反应的装置图,对该反应叙述正确的是( )
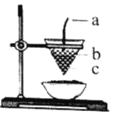
A. 图中a为镁条,b为KClO3,c为Al2O3和Fe的混合物
B. 铝热反应是放热反应,所以常温下可以发生反应
C. KClO3是该反应的催化剂
D. 利用铝热反应可焊接钢轨,也可冶炼锰等难熔金属
【答案】D
【解析】
A.铝热反应中,金属单质为Al,另一种氧化物对应金属的活泼性比铝小;
B.铝热反应需要在高温下发生;
C.氯酸钾受热可分解产生氧气,助燃;
D.通过铝热反应可以制取少量难熔金属单质。
A. c为Al2O3和Fe的混合物时,无法构成铝热剂,c可以为Fe2O3和Al的混合物,A项错误;
B. 铝热反应是放热反应,但是铝热反应需要在高温下发生,B项错误;
C. Mg燃烧放热,氯酸钾受热可分解产生氧气,所以氯酸钾的作用是助燃,C项错误;
D. 铝热反应可以制取少量难熔金属,故利用铝热反应可焊接钢轨,也可冶炼锰等难熔金属,D项正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
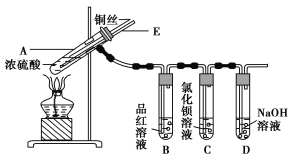
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。