题目内容
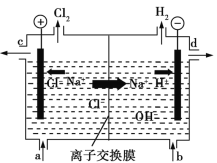
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
回答下列问题:
(1)写出电解饱和食盐水的离子方程式:_______________________________。
(2)离子交换膜的作用为_________________。
(3)精制饱和食盐水从图中____(填“a”、“b”、“c”或“d”,下同)位置补充,氢氧化钠溶液从图中____位置流出。
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式:____________________________。
【答案】2H2O +2Cl-![]() Cl2↑+2OH-+H2↑ 能得到纯度较高的氢氧化钠溶液,避免Cl2与H2反应(其他答案合理即可) a d 2KClO3 + 2H2SO4+H2C2O4
Cl2↑+2OH-+H2↑ 能得到纯度较高的氢氧化钠溶液,避免Cl2与H2反应(其他答案合理即可) a d 2KClO3 + 2H2SO4+H2C2O4![]() 2ClO2↑+2CO2↑+2KHSO4+2H2O
2ClO2↑+2CO2↑+2KHSO4+2H2O
【解析】
(1)电解精制饱和食盐水生成氯气、氢气、烧碱;
(2)阳离子交换膜只能让阳离子通过,阴离子和气体不能通过;
(3)电解饱和食盐水时,阳极上阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的电极反应式为:2Cl—-2e-═Cl2![]() ,阴极H+放电,电极反应式为:2H++2e-═H2
,阴极H+放电,电极反应式为:2H++2e-═H2![]() ;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极生成,精制饱和食盐水从阳极进入;
;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极生成,精制饱和食盐水从阳极进入;
(4)KClO3有氧化性,草酸(H2C2O4)有还原性,在硫酸提供酸性环境下反应生成ClO2,还生成CO2和KHSO4等物质,依据电子守恒和原子守恒,可得该反应的化学方程式。
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:![]() ,
,
本题答案为:![]() ;
;
(2)阳离子交换膜只能让阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
本题答案为:能得到纯度较高的氢氧化钠溶液,避免Cl2与H2反应;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,根据装置图分析可以知道精制饱和食盐水从阳极进入,即进口为a;
本题答案为:a,d;
(4)KClO3有氧化性,草酸(H2C2O4)有还原性,在硫酸提供酸性环境下反应生ClO2,还生成CO2和KHSO4等物质,依据电子守恒和原子守恒,可得该反应的化学方程式:2KClO3 + 2H2SO4+H2C2O4![]() 2ClO2↑+2CO2↑+2KHSO4+2H2O;
2ClO2↑+2CO2↑+2KHSO4+2H2O;
本题答案为:2KClO3 + 2H2SO4+H2C2O4![]() 2ClO2↑+2CO2↑+2KHSO4+2H2O。
2ClO2↑+2CO2↑+2KHSO4+2H2O。

【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应 X(g)+Y(g) ![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.反应前2 min的平均速率v(Y)=4.0×10-3 mol/(L·min)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反应2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),则平衡_________移动(填“正向”或“逆向”),达到新平衡后c(CO)将_________(填“变大”、“变小”或“不变”)
(2)在T℃时,反应 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_________
②下列说法正确的是_________(填字母)。
A.若容器压强恒定,说明反应达到平衡状态
B.增加Fe2O3的量能提高CO的转化率
C.甲容器中CO的平衡转化率大于乙的平衡转化率
D.若容器中固体质量不再改变,说明反应达到平衡状态
③取五等份CO,分别加入温度不同但容积相同的恒容密闭容器中(已装有足量Fe2O3),反应相同时间后,分别测定体系中CO的体积分数(CO%),并作出其随反应温度(T)变化的关系图,请在答题卡中作出平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图。
_________