��Ŀ����
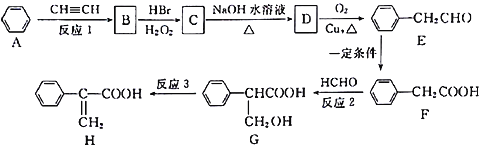
����Ŀ��������H��һ���л��������м��塣ʵ�����ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·��ͼ���£�
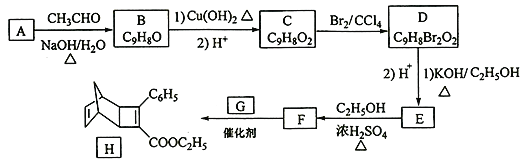
��֪����![]()
��![]()
�ش��������⣺
��1��A�Ļ�ѧ������________________��������й�ƽ���ԭ�������____����
��2����B����C��1���ķ�Ӧ��������________________��
��3��E�Ľṹ��ʽΪ________________��
��4��F�����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��5��G��һ�ȴ�����_______�֡�
��6�����㻯����X��F��ͬ���칹�壬X�����뱥��̼��������Һ��Ӧ�ų�CO2����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6:2:1:1��д������Ҫ���X�Ľṹ��ʽ_________________��
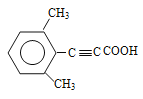
��7��д���û������2-��ȲΪԭ���Ʊ�������![]() �ĺϳ�·��ͼ___________�������Լ���ѡ����
�ĺϳ�·��ͼ___________�������Լ���ѡ����
���𰸡� ����ȩ 14 ������Ӧ 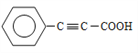
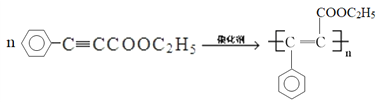 3
3 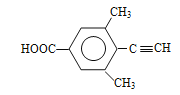 ��
�� ��
�� ��
��
������������������Ϣ�ٿ�֪��AΪ����ȩ���ṹ��ʽΪ![]() ��BΪ
��BΪ![]() ��B�����Ƶ�������ͭ�������ữ������C����CΪ
��B�����Ƶ�������ͭ�������ữ������C����CΪ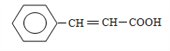 ��C���巢���ӳɷ�Ӧ����D����DΪ
��C���巢���ӳɷ�Ӧ����D����DΪ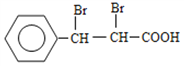 ��D������ȥ��Ӧ���ữ��õ�E����EΪ
��D������ȥ��Ӧ���ữ��õ�E����EΪ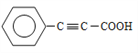 ��E���Ҵ�����������Ӧ����F����FΪ
��E���Ҵ�����������Ӧ����F����FΪ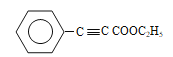 ��F��G������Ϣ�ڷ�Ӧ����H����GΪ
��F��G������Ϣ�ڷ�Ӧ����H����GΪ![]() ���ݴ˽����
���ݴ˽����
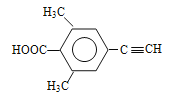
�⣺��1��A�Ľṹ��ʽΪ![]() ����ѧ�����DZ���ȩ������ȩ���ͱ�������ƽ���νṹ����������й�ƽ���ԭ�������14����
����ѧ�����DZ���ȩ������ȩ���ͱ�������ƽ���νṹ����������й�ƽ���ԭ�������14����
��2���������Ϸ�����֪��B����C��1���ķ�Ӧ��������������Ӧ��
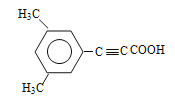
��3��E�Ľṹ��ʽΪ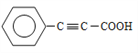 ��
��
��4��FΪ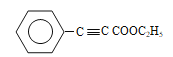 �������Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ
�������Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ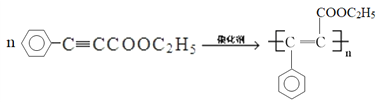 ��
��
��5��GΪ![]() �������к���3����ԭ�ӣ�G��һ�ȴ�����3�֡�
�������к���3����ԭ�ӣ�G��һ�ȴ�����3�֡�
��6�����㻯����X��F��ͬ���칹�壬X���뱥��̼��������Һ��Ӧ�ų�CO2����X���������Ȼ�����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6��2��1��1������Ҫ���X�Ľṹ��ʽΪ ��
�� ��
�� ��
�� ������4�֣�
������4�֣�
��7���û������2-��ȲΪԭ���Ʊ�������![]() ���������û��������壨���������ڹ��������·���ȡ����Ӧ����һ�廷���飨��һ�Ȼ����飩��Ȼ��һ�廷���鷢����ȥ��Ӧ���ɻ���ϩ������ϩ��2-��Ȳ������Ϣ�ڷ�Ӧ�������������巢���ӳɷ�Ӧ���ɵõ���Ʒ������ϳ�·��������
���������û��������壨���������ڹ��������·���ȡ����Ӧ����һ�廷���飨��һ�Ȼ����飩��Ȼ��һ�廷���鷢����ȥ��Ӧ���ɻ���ϩ������ϩ��2-��Ȳ������Ϣ�ڷ�Ӧ�������������巢���ӳɷ�Ӧ���ɵõ���Ʒ������ϳ�·�������� ��
��

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�