题目内容
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
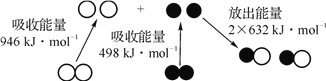
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
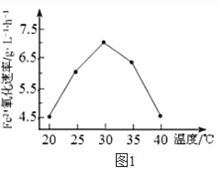
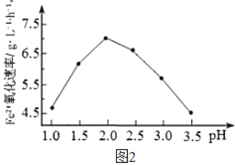
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。
方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
【答案】 催化作用(或作催化剂) 30℃、pH=2.0 硫杆菌失去活性(或蛋白质变性) H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 6.0×10-3mol·L-1 0.62
【解析】试题分析:本题考查外界条件对化学反应速率和化学平衡的影响,化学图像的分析,得失电子守恒的应用,电离平衡常数的计算。
I(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,硫杆菌能明显加快反应速率,硫杆菌的作用是作催化剂。
(2)由图1知使用硫杆菌的最佳温度为30℃,由图2知使用硫杆菌的最佳pH为2.0,使用硫杆菌的最佳条件为30℃、pH=2.0。若温度过高,硫杆菌受热发生变性失去活性,反应速率下降。
(3)在反应中H2O2作氧化剂被还原成H2O,1molH2O2反应得到2mol电子,当n(H2O2)/n(H2S)=4时,根据得失电子守恒,4molH2O2反应得到8mol电子,1molH2S氧化失去8mol电子,则氧化产物为H2SO4(反应的化学方程式为4H2O2+H2S=H2SO4+4H2O)。
II(4)过程①为用NaOH溶液吸收SO2生成Na2SO3,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,反应的离子方程式为:SO2+2OH-=SO32-+H2O。
(5)向Na2SO3溶液中加入生石灰,生石灰与水作用产生Ca2+,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
(6)氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,溶液中c(NH4+)=c(OH-),由于NH3·H2O的电离程度很小,c(NH3·H2O)=2.0mol/L-c(NH4+)
NH4++OH-,溶液中c(NH4+)=c(OH-),由于NH3·H2O的电离程度很小,c(NH3·H2O)=2.0mol/L-c(NH4+)![]() 2.0mol/L,NH3·H2O的Kb=1.8
2.0mol/L,NH3·H2O的Kb=1.8![]() 10-5=[c(NH4+)·c(OH-)]/ c(NH3·H2O)= c2(OH-)/2.0,c(OH-)=6
10-5=[c(NH4+)·c(OH-)]/ c(NH3·H2O)= c2(OH-)/2.0,c(OH-)=6![]() 10-3mol/L。25℃时c(OH-)=1
10-3mol/L。25℃时c(OH-)=1![]() 10-7mol/L的溶液中c(H+)=1
10-7mol/L的溶液中c(H+)=1![]() 10-7mol/L ,H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-),则c(SO32-)/c(HSO3-)= Ka2/ c(H+)=6.2
10-7mol/L ,H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-),则c(SO32-)/c(HSO3-)= Ka2/ c(H+)=6.2![]() 10-8
10-8![]() (1
(1![]() 10-7)=0.62。
10-7)=0.62。