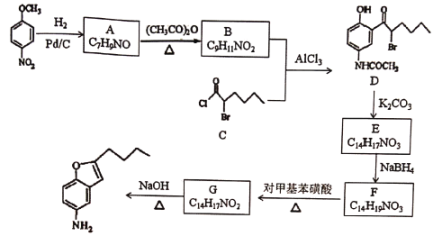
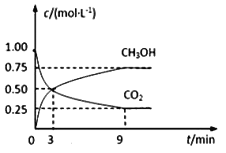
题目内容
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
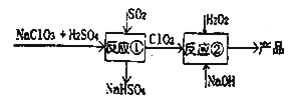
下列说法不正确的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为21
B.反应①氧化产物与还原产物的物质的量之比为1:1
C.反应②条件下,ClO2的氧化性大于H2O2反应
D.②中的H2O2可用NaClO4代替
【答案】BD
【解析】
A.反应①化学方程式为:2NaClO3+H2SO4+SO2=2NaHSO4+2ClO2因此参加反应的NaClO3和SO2的物质的量之比为2:1,选项正确,A不符合题意;
B.反应①中氧化产物为NaHSO4,还原产物为ClO2 , 二者的物质的量之比为1:2,选项错误,B符合题意;
C.反应②的化学方程式为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O,该反应中,氧化剂为ClO2,还原剂为H2O2,因此ClO2的氧化性强于H2O2,选项正确,C不符合题意;
D.反应②中H2O2体现还原性,而NaClO4中的氯元素的化合价为+7价,氯元素的最高价态,氯元素不具有还原性,故不可用NaClO4代替H2O2 , 选项错误,D符合题意;
故答案为:BD。

【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
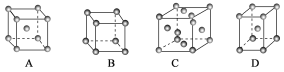
【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
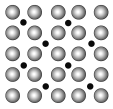
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
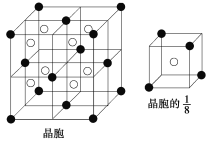
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。