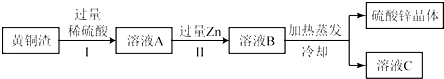
��Ŀ����
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ�������
�¶�/�� | 25��C | 99��C |
ˮ�����ӻ����� | 1��l0-14 | 1��l0-12 |
�Իش��������������Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ���
��1��25��ʱ����pH=11�Ŀ�������ҺV1L��pH=1��ϡ����V2L��ϣ����û����Һ��pH=2����V1��V2 =___________������Һ�и������ӵ�Ũ���ɴ�С��˳����_________________��
��2��99��ʱ����pH=2�������pH=10������������Һ�������ϣ�������Һ�е�c��H+��=__mol��L-1��
��3������H2A��ǿ�ᣬ��������0.1mol��L-1H2A����Һ��c ��H+��=0.11mol L-1����NaHA��Һ��___________��������������������������������0. lmol��L-1��NaHA��Һ��c��H+��________0. 0lmol L-1 ������>������<������=������H2A��Һ��Na2A��Һ��Ӧ�����ӷ���ʽΪ_____________________��
���𰸡� 90��11 c��H+��>c��SO42-��>c��Na+��>c��OH-�� 10-6 �� > H++A2-=HA-
��������������������⿼��pH�ļ�������Һ������Ũ�ȵĴ�С��ϵ����������Ե���ƽ���Ӱ���Լ����ӷ���ʽ����д��
��1����Ϻ���ҺpH=2��NaOH��ϡ���ᷴӦ�����������1![]() 10-2mol/L=��1
10-2mol/L=��1![]() 10-1mol/LV2L-1
10-1mol/LV2L-1![]() 10-3mol/LV1L��
10-3mol/LV1L��![]() ��V1+V2��L��V1��V2 =90:11��ԭNaOH��Һ��c��Na+��=1
��V1+V2��L��V1��V2 =90:11��ԭNaOH��Һ��c��Na+��=1![]() 10-3mol/L��ԭϡ������c��SO42-��=0.05mol/L����Ϻ�c��Na+��=1
10-3mol/L��ԭϡ������c��SO42-��=0.05mol/L����Ϻ�c��Na+��=1![]() 10-3mol/LV1L
10-3mol/LV1L![]() ��V1+V2��L=8.91
��V1+V2��L=8.91![]() 10-4mol/L��c��SO42-��=0.05mol/LV2L
10-4mol/L��c��SO42-��=0.05mol/LV2L![]() ��V1+V2��L=5.45
��V1+V2��L=5.45![]() 10-3mol/L����ʱ��������Ũ���ɴ�С��˳��Ϊc��H+��>c��SO42-��>c��Na+��>c��OH-����
10-3mol/L����ʱ��������Ũ���ɴ�С��˳��Ϊc��H+��>c��SO42-��>c��Na+��>c��OH-����
��2��99����pH=2��������Һ��c��H+��=1![]() 10-2mol/L��pH=10��NaOH��Һ��c��OH-��=1
10-2mol/L��pH=10��NaOH��Һ��c��OH-��=1![]() 10-12
10-12![]() ��1
��1![]() 10-10��=1
10-10��=1![]() 10-2mol/L�����ߵ�������ǡ����ȫ��Ӧ����Һ�����ԣ�99��������Һ��c��H+��=1
10-2mol/L�����ߵ�������ǡ����ȫ��Ӧ����Һ�����ԣ�99��������Һ��c��H+��=1![]() 10-6mol/L�������Һ��c��H+��=1
10-6mol/L�������Һ��c��H+��=1![]() 10-6mol/L��
10-6mol/L��
��3������H2A��ǿ�ᣬ��������0.1mol��L-1H2A����Һ��c ��H+��=0.11mol L-1��˵��H2A��ˮ��Һ�еĵ��뷽��ʽΪ��H2A=H++HA-��HA-![]() H++A2-����һ�������c��H+��=0.1mol/L���ڶ����������c��H+��=0.01mol/L��NaHA��Һ�д��ڵĵ��뷽��ʽΪ��NaHA=Na++HA-��HA-
H++A2-����һ�������c��H+��=0.1mol/L���ڶ����������c��H+��=0.01mol/L��NaHA��Һ�д��ڵĵ��뷽��ʽΪ��NaHA=Na++HA-��HA-![]() H++A2-��NaHA��Һ��������0. lmol��L-1��NaHA��Һ��c��H+��
H++A2-��NaHA��Һ��������0. lmol��L-1��NaHA��Һ��c��H+��![]() 0. 0lmol L-1��ԭ���ǣ���0.1mol/LH2A��Һ����H2A��Һ��H2A��һ���������H+��HA-�ĵ�������������������H2A��ǿ�ᣬд���ӷ���ʽӦ��д��H+��HA-����H2A��Һ��Na2A��Һ��Ӧ�����ӷ���ʽΪ��H++A2-=HA-��
0. 0lmol L-1��ԭ���ǣ���0.1mol/LH2A��Һ����H2A��Һ��H2A��һ���������H+��HA-�ĵ�������������������H2A��ǿ�ᣬд���ӷ���ʽӦ��д��H+��HA-����H2A��Һ��Na2A��Һ��Ӧ�����ӷ���ʽΪ��H++A2-=HA-��

 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�