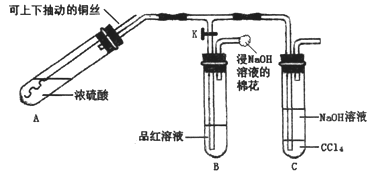
题目内容
【题目】合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是(填字母序号,下同).
A.青花瓷瓶
B.橡胶充气艇
C.不锈钢锅
(2)生铁是常用的合金,生铁属于(填“纯净物”或“混合物”).
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 .
(4)黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应): 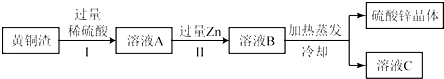
已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
①Ⅱ中反应的化学方程式为;
②下列说法正确的是 .
a.Ⅰ、Ⅱ中的操作均包含过滤 b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A 的质量小于溶液B d.溶液C中溶质的质量分数小于溶液B.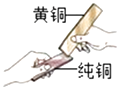
【答案】
(1)C
(2)混合物
(3)黄铜硬度比纯铜大
(4)Zn+CuSO4=ZnSO4+Cu;abc
【解析】解:(1)青花瓷瓶属于硅酸盐材料;橡胶充气艇属于有机高分子材料;不锈钢锅属于合金,所以答案是:C;(2)生铁是常用的合金,合金属于混合物,故生铁属于混合物,所以答案是:混合物;(3)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大,所以答案是:黄铜的硬度比纯铜的硬度大;(4)①由于锌排在氢和铜的前面,故锌既可以与酸反应,也可以与硫酸铜反应,反应的化学方程式分别为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu, 所以答案是:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu;
②由图可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜;
因氧化锌的质量大于氧化铜,另外锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜;
溶液A加入锌后,反应的化学方程式分别为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu;对反应Zn+H2SO4═ZnSO4+H2↑分析可知,每65份质量的锌进入溶液,从溶液中出来2份质量的氢气,使得溶液质量增加,对于反应Zn+CuSO4=ZnSO4+Cu来说,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,也使得溶液质量增大;故溶液A的质量小于溶液B;溶液C为饱和溶液,质量分数达到同温度下的最大值,故d错误,
所以答案是:abc.

【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25°C | 99°C |
水的离子积常数 | 1×l0-14 | 1×l0-12 |
试回答以下问题(设混合后溶液的体积为原两溶液体积之和):
(1)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合,所得混合溶液的pH=2,则V1:V2 =___________。此溶液中各种离子的浓度由大到小的顺序是_________________。
(2)99℃时,将pH=2的硫酸和pH=10的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__mol·L-1。
(3)假设H2A是强酸,但常温下0.1mol·L-1H2A的溶液中c (H+)=0.11mol L-1,则NaHA溶液呈___________性(填“酸”、“碱”或“中”),0. lmol·L-1的NaHA溶液的c(H+)________0. 0lmol L-1 (填“>”、“<”或“=”);H2A溶液与Na2A溶液反应的离子方程式为_____________________。