题目内容
10.废水、废气、废渣的处理是减少污染、保护环境的重要措施
(1)SO2能造成酸雨,向煤中加生石灰可以减少其排放,原理的方程式为2SO2+2CaO+O2=2CaSO4.
(2)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(3)用NH3还原NOx生成N2和H2O.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
(4)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
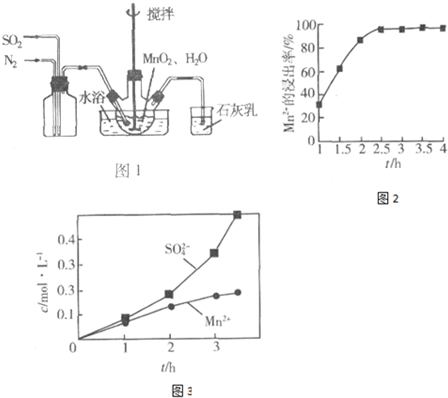
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图1所示.
该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③检验生成该物质的最简单操作的名称丁达尔效应.
(5)SO2经催化氧化可生成SO3,该反应的热化学方程式为:
2SO2(g)+O2(g)?2SO3(g)△H=-a kJ•mol-1
在T1℃时,将2mol SO2、1mol O2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=196.6,T1℃时,上述反应的平衡常数K1=4_.若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2.则K1> K2 (填“>”、“<”或“=”).
(6)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图2所示.
①氮化硅的化学式为Si3N4.
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:NH4++3F--6e-=NF3+4H+;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
分析 (1)二氧化硫与氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙;
(2)已知:①.N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②.2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
③.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g);
(3)相同条件下,气体体积之比等于其物质的量之比,假设NO、NO2的混合气体为3mol,氨气为3.5mol,由于反应生成N2和H2O,根据H原子守恒计算H2O的物质的量,设NO、NO2的物质的量分别为xmol、ymol,由二者物质的量之和及氧原子守恒列方程计算解答;
(4)①由题目信息可知,N2H4与Cu(OH)2生成Cu2O、N2,由元素守恒可知有水生成,配平书写方程式;
②阳极发生氧化反应,Cu失去电子,与通过阴离子交换膜的氢氧根离子反应生成Cu2O、与水;
③由于得到纳米级Cu2O,具有胶体的性质,可以用丁达尔效应检验;
(5)测得SO2的平衡转化率为50%,则参加反应的SO2为2mol×50%=1mol,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1 0
转化(mol):1 0.5 1
平衡(mol):1 0.5 1
计算2molSO2反应放出的热量可得a的值;
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$,代入平衡浓度计算;
若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,该反应正反应为放热反应,随反应进行,容器内温度升高,平衡会向逆反应进行,平衡常数减小;
(6)①氮化硅的化学式为Si3N4;
②由图可知,b极产生氢气,发生还原反应,b为阴极,则a为阳极,阳极发生氧化反应,NH4F失去电子得到
NF3,还有H+生成;电解过程中还会生成少量氧化性极强的气体单质,该单质为氟气.
解答 解:(1)二氧化硫与氧化钙反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,总反应方程式为:2SO2+2CaO+O2=2CaSO4,
故答案为:2SO2+2CaO+O2=2CaSO4;
(2)已知:①.N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②.2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
③.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),所以△H=(-393.5kJ/mol)×2-(-221.0kJ/mol)-(+180.5kJ/mol)=-746.5 kJ/mol,
故热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol;
(3)相同条件下,气体体积之比等于其物质的量之比,假设NO、NO2的混合气体为3mol,氨气为3.5mol,由于反应生成N2和H2O,根据H原子守恒,则生成H2O的物质的量$\frac{3.5mol×3}{2}$=5.25mol,设NO、NO2的物质的量分别为xmol、ymol,由二者物质的量之和及氧原子守恒可得则:$\left\{\begin{array}{l}{x+y=3}\\{x+2y=5.25}\end{array}\right.$,解得x=0.75、y=2.25,故NO、NO2的物质的量之比为0.75mol:2.25mol=1:3,
故答案为:1:3;
(4)①由题目信息可知,N2H4与Cu(OH)2生成Cu2O、N2,由元素守恒可知有水生成,配平方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O;
②阳极发生氧化反应,Cu失去电子,与通过阴离子交换膜的氢氧根离子反应生成Cu2O、与水,该电解池的阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
③由于得到纳米级Cu2O,具有胶体的性质,可以用丁达尔效应检验,故答案为:丁达尔效应;
(5)测得SO2的平衡转化率为50%,则参加反应的SO2为2mol×50%=1mol,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1 0
转化(mol):1 0.5 1
平衡(mol):1 0.5 1
1molSO2反应放出热量98.3kJ,则2molSO2反应放出的热量为98.3kJ×2=196.6kJ,故反应热△H-196.6kJ/mol,则a=196.6;
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{(\frac{1}{2})^{2}}{(\frac{1}{2})^{2}×\frac{0.5}{2}}$=4;
若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2,该反应正反应为放热反应,随反应进行,容器内温度升高,平衡会向逆反应进行,平衡常数减小,即K1>K2,
故答案为:196.6;4;>;
(6)①氮化硅的化学式为Si3N4,故答案为:Si3N4;
②由图可知,b极产生氢气,发生还原反应,b为阴极,则a为阳极,阳极发生氧化反应,NH4F失去电子得到
NF3,还有H+生成,电极反应式为:NH4++3F--6e-=NF3+4H+;电解过程中还会生成少量氧化性极强的气体单质,该单质为F2,
故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题考查热化学方程式书写、混合物有关计算、化学平衡计算、电解池应用等,属于拼合型题目,需要学生具备扎实的基础,较好的考查学生运用知识分析解决问题的能力、对信息处理能力,难度中等.

 阅读快车系列答案
阅读快车系列答案 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发所有水分得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| B. | 4~6min的平均反应速率:v(H2O2)<3.3×10-2mol•L-1•min-1 | |
| C. | 反应至6 min时,c(H2O2)=0.30 mol•L-1 | |
| D. | 反应至6 min时,H2O2分解了50% |

 在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求
在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求