题目内容
下列图示与对应的叙述相符的是 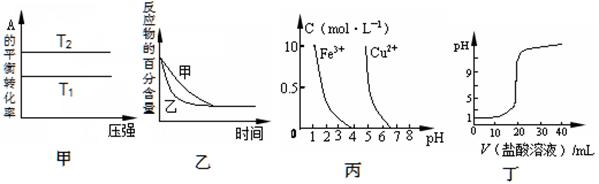
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
A
解析试题分析:A、若T1>T2,温度升高A的转化率降低,说明升高温度平衡逆向移动,则正向是放热反应,△H<0,正确;B、图乙表示是否使用催化剂,因为到达平衡的时间改变而反应物的百分含量不变,说明平衡不移动,所以乙代表使用了催化剂,错误;C、调节溶液的pH=4,溶液呈酸性,若加入氢氧化钠溶液,则溶液呈碱性,铜离子也会沉淀,错误;D、用盐酸滴定氢氧化钠溶液,开始的pH是氢氧化钠溶液的pH值,应大于7,错误,答案选A。
考点:考查化学平衡理论、溶液的pH值与图像的对应关系

练习册系列答案
相关题目
一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是( )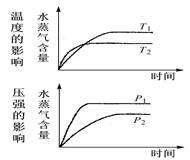
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0 CO(NH2)2(s)+H2O(g); △H<0 |
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0 CO(g)+H2O(g); △H>0 |
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0 CH2=CH2(g)+ H2O(g); △H>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0 2C6H-5CH=CH2(g)+2H2O(g); △H<0 |
下列说法不正确的是
| A.在自然界中存在的单质,一定具备化学性质稳定、不与其它物质发生反应这一特征 |
| B.100多年前,英国曾耗巨资改建高炉,试图延长CO和Fe2O3的接触时间,以减少CO的排放,这违背了化学反应都有一定限度这一基本原理 |
| C.在溶液中,有色物质参与的反应,可以用分光光度计来测定其化学反应速率 |
| D.虽然碳酸钙分解需要吸收大量的热,但在高温条件下也能自发进行 |
1000℃时,FeO(s) + H2 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
| A.1.0 | B.2.0 | C.3.0 | D.4.0 |
一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
| A.c1:c2 = 1:3 | B.平衡时,Y和Z的生成速率之比为3:2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0 < c1 < 0.14mol/L |
(2013?吉林模拟)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
已知N2O4(g)?2NO2(g) △H>0且平衡体系的总质量(m总 )与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )
| A.平衡常数K(a)=K(b)<K(c) |
| B.反应速率:va<vb; |
| C.温度:T2>T1 |
D.当 =69g/mol时,若n(NO2):n(N2O4)=2:1, =69g/mol时,若n(NO2):n(N2O4)=2:1, |
 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是