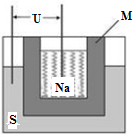
题目内容
常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则乙的电子式为 ;生成标准状况下5.6L丙转移的电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则①A在周期表中位置为 ②丁与水反应的化学方程式为 向反应后溶液中滴加两滴紫色石蕊试液的现象为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MCl沉淀,写出该反应的离子方程式 。
(1)
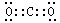 0.5NA > CO32-+H2O
0.5NA > CO32-+H2O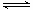 HCO3-+OH- HCO3-+H2O
HCO3-+OH- HCO3-+H2O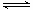 H2CO3+OH-
H2CO3+OH-
(2)①第二周期Ⅵ族
②SO2+ H2O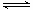 H2SO3 紫色石蕊试液变红
H2SO3 紫色石蕊试液变红
③2Cu2O+Cu2S="6Cu+" SO2↑
④2Cu2++2Cl-+ SO2+ 2H2O =" 2CuCl↓+" SO42-+ 4H+
解析试题分析:(1)由甲为淡黄色固体且是两种元素(A和M)组成的化合物,容易推出其为Na2O2,再由乙(B和M组成)和丙(只含有M)均为常温下的无色无味气体及反应:甲+乙=丙+丁,可推出乙为CO2、丙为O2、丁为Na2CO3;甲+乙=丙+丁即为2Na2O2+2CO2= O2↑+2Na2CO3,每2mol Na2O2参加反应产生1mol O2,转移2mol电子,因此标况下5.6L O2(即0.25mol)转移电子数为0.5 NA个;丁溶液为Na2CO3溶液,其为强碱弱酸盐,显碱性,故pH>7,显碱性的原因是由于CO32-的水解导致。
(2)由题意容易推出丁为SO2(元素A和B),丙为Cu(元素M),由于原子序数B大于A,故A为O、B为S、M为Cu;SO2溶于水生成H2SO3,能电离出H+,使溶液呈酸性,因此它能使紫色石蕊试液变红,但它的漂白性是和一些具特定官能团的有色有机物化合生成不稳定的无色物质,而石蕊不具备这样的官能团,故不能使其褪色;由化合物甲、乙中原子个数比均为1:2(M均显+1价),可得出甲为Cu2O、乙为Cu2S,则反应式为2Cu2O+Cu2S="6Cu+" SO2↑;CuCl2的溶液中通入SO2,可观察到白色的CuCl沉淀,则发生了氧化还原反应,Cu2+被还原为Cu+,故SO2被氧化为SO42-。
考点:电子式的书写,盐类的水解,元素周期表结构,氧化还原反应,SO2的性质。

 阅读快车系列答案
阅读快车系列答案根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是 。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
在Na和Na+ 两种粒子中,相同的是
| A.核外电子数 | B.核内质子数 | C.最外层电子数 | D.核外电子层数 |
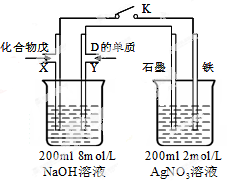
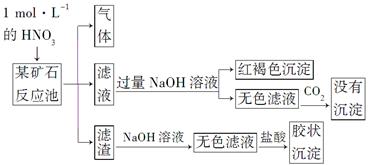
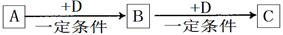
 CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。