题目内容
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
【答案】D
【解析】
氯碱工业中的总反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑;电解池中阳极失电子发生氧化反应,氯碱工业中Cl2为氧化产物,所以电极A为阳极,电极B为阴极,据此作答。
2OH-+H2↑+Cl2↑;电解池中阳极失电子发生氧化反应,氯碱工业中Cl2为氧化产物,所以电极A为阳极,电极B为阴极,据此作答。
A.根据分析可知电极A为阳极,发生氧化反应生成氯气,故A正确;
B.阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;为了防止生成的氯气与氢氧化钠发生反应,氢氧化钠要从b口流出,所以要防止OH-流向阳极即电极A,该离子交换膜为阳离子交换膜,故B正确;
C.根据B选项的分析可知饱和NaCl从a处进,NaOH溶液从d处出,故C正确;
D.根据总反应方程式可知当反应中转移4mol电子时,生成2mol OH-,故D错误;
故答案为D。

【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L-1·min-1
B.该反应在10min后才达到平衡
C.物质B的平衡转化率为20%
D.平衡状态时,c(C)=0.6mol·L-1
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
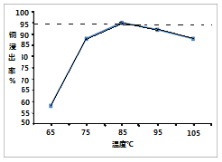
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
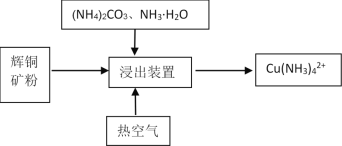
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。

