题目内容
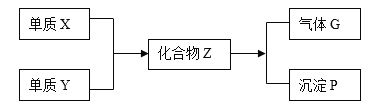
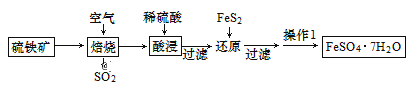
【题目】绿矾别名青矾、皂荚矾等,是我国古代常用的药材,以硫铁矿[主要成分为二硫化亚铁(FeS2)]为原料制备绿矾晶体,工艺流程如下:
下列说法正确的是( )
A.焙烧过程中每生成1molSO2转移电子数为5NA
B.还原后所得滤液可用高锰酸钾检验Fe3+是否反应完全
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3
D.操作1为蒸发结晶
【答案】C
【解析】
由制备流程可知,在空气中焙烧发生4FeS2+11O2 ![]() 2Fe2O3+8SO2,酸浸发生Fe2O3+6H+=2Fe3++3H2O,还原时发生FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,过滤后,操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O,以此来解答。
2Fe2O3+8SO2,酸浸发生Fe2O3+6H+=2Fe3++3H2O,还原时发生FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,过滤后,操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O,以此来解答。
A.焙烧发生4FeS2+11O2![]() 2Fe2O3+8SO2,生成8molSO2时转移44mol电子,则每生成1molSO2转移电子数为5.5NA,故A错误;
2Fe2O3+8SO2,生成8molSO2时转移44mol电子,则每生成1molSO2转移电子数为5.5NA,故A错误;
B.还原后所得滤液可用KSCN溶液检验Fe3+是否反应完全,亚铁离子可被高锰酸钾氧化,故B错误;
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3,与硫酸反应生成硫酸亚铁,故C正确;
D.由溶液得到含结晶水的晶体,可知操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故D错误;
故答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】回答下列问题:
(1)在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___。
(2)1.00L 1.00mol/LH2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为___。
(3)已知反应CH3-CH3→CH2=CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能E/kJ/mol | 414.4 | 615.3 | 347.4 | 435.3 |
通过计算得出该反应的反应热为_______________。
(4)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和H2O(g)时,放出33.4kJ的热量,则该反应的热化学方程式为________。