题目内容
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量____________
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为____________
(4)根据图像,写出反应的热化学方程式:
① ____________
____________
②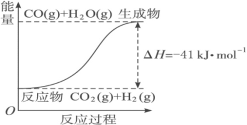 ____________
____________
【答案】CH3OH(l) +![]() O2(g)=CO2(g) + 2H2O(l) △H= - 725.76kJ/mol N2(g) + 2O2 (g) = 2NO2(g) △H= +67.8kJ/mol N2(g) + 3H2(g) = 2NH3(g) △H= -92kJ/ mol CO(g)+H2O(g)= CO2(g)+H2(g) △H= - 41kJ /mol CO2(g)+H2(g)= CO(g)+H2O(g) △H= +41kJ /mol
O2(g)=CO2(g) + 2H2O(l) △H= - 725.76kJ/mol N2(g) + 2O2 (g) = 2NO2(g) △H= +67.8kJ/mol N2(g) + 3H2(g) = 2NH3(g) △H= -92kJ/ mol CO(g)+H2O(g)= CO2(g)+H2(g) △H= - 41kJ /mol CO2(g)+H2(g)= CO(g)+H2O(g) △H= +41kJ /mol
【解析】
(1).燃烧热是1mol 可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.76kJ;
(2).适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,结合焓变及状态书写热化学方程式;
(3).焓变等于断裂化学键吸收的能量减去成键释放的能量,结合焓变及状态书写热化学方程式;
(4).书写热化学方程式,要表明反应物、生成物的状态,放热反应的反应热小于零,吸热反应的反应热大于零;反应物生成物颠倒,反应热正负颠倒。
(1).在25℃、101kPa 下,1g甲醇(CH3 OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为:22.68kJ×32=725.76kJ,所以甲醇燃烧热的热化学方程式:CH3OH(l) + ![]() O2(g)=CO2(g) + 2H2O(l) △H= - 725.76KJ/mol,故答案为:CH3OH(l) +
O2(g)=CO2(g) + 2H2O(l) △H= - 725.76KJ/mol,故答案为:CH3OH(l) +![]() O2(g)=CO2(g) + 2H2O(l) △H= - 725.76kJ/mol;
O2(g)=CO2(g) + 2H2O(l) △H= - 725.76kJ/mol;
(2).适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g) + 2O2 (g) = 2NO2(g)△H= +67.8kJ./mol;故答案为:N2(g) + 2O2 (g) = 2NO2(g)△H= +67.8kJ./mol;
(3).在反应N2 + 3H2=2NH3中,断裂3molH-H键,1molN≡N键共吸收的能量为:3×436kJ + 946kJ = 2254kJ,生成2molNH3,共形成6molN-H键,放出的能量为:6×391kJ = 2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ - 2254kJ= 92kJ,则N2与H2反应生成NH3的热化学方程式为:N2(g) + 3H2(g) = 2NH3(g)△H= -92kJ/ mol;故答案为:N2(g) + 3H2(g) = 2NH3(g)△H= -92kJ/ mol;
(4).书写热化学方程式,要表明反应物、生成物的状态,放热反应的反应热小于零,吸热反应的反应热大于零;反应物生成物颠倒,反应热正负颠倒;故答案为:①CO(g)+H2O(g)= CO2(g)+H2(g) △H= - 41kJ /mol;②CO2(g)+H2(g)= CO(g)+H2O(g) △H= +41kJ /mol。