题目内容
8.Na2SO3?7H20晶体加热脱水后,强热过程中质量不变.待固体冷却后溶于水,溶液的碱性比Na2SO3溶液强,所得固体成分可能是( )| A. | Na2S Na2O Na2SO3 | B. | Na2SO4Na2O Na2SO3 | ||
| C. | Na2O Na2S Na2SO4 | D. | Na2S Na2SO3 |
分析 亚硫酸钠中硫元素处于中间价态,既有氧化性又有还原性,强热分解质量不变,依据氧化还原反应的规律和原子个数守恒定律解答.
解答 解:A.若分解产物为:Na2S;Na2O;Na2SO3,则反应中只有化合价降低,没有化合价升高,不符合氧化还原反应的规律,故A错误;
B.若分解产物为:Na2SO4;Na2O;Na2SO3,则反应中只有化合价升高,没有化合价降低,不符合氧化还原反应的规律,故B错误;
C.Na2SO3•7H20中钠原子与硫原子个数比为2:1,若分解产物为:Na2O;Na2S;Na2SO4,钠原子与硫原子个数比不为2:1,不符合质量守恒定律,故C错误;
D.若产物为:Na2S,Na2SO3则发生反应:4Na2SO3=3Na2SO4+Na2S,符合题意,故D正确;
故选:D.
点评 本题考查了物质的性质,明确氧化还原反应的规律、熟悉亚硫酸钠的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
16.密度为1.45g/ml的H2SO4溶液中,逐滴加入BaCl2溶液,直到SO42-全部沉淀为止,已知沉淀的质量与原来H2SO4溶液的质量相等,则原来H2SO4溶液的浓度为( )
| A. | 29.6% | B. | 21% | C. | 6.22 mol/L | D. | 12.4mol/L |
3.只用水不能鉴别的一组物质是( )
| A. | 苯和四氯化碳 | B. | 乙酸乙酯和乙醇 | C. | 乙醇和乙酸 | D. | 苯和溴苯 |
20.下列微粒中,同时具有离子键、共价键和配位键的是( )
| A. | NaOH | B. | H3O+ | C. | MgCl2 | D. | NH4Cl |
17.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入过量的二氧化硫:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ | |
| B. | 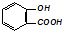 溶液中加入过量的碳酸钠: 溶液中加入过量的碳酸钠: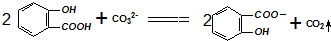 | |
| C. | 硝酸铁溶液中加入少量的氢碘酸2NO3-+8H++6I-=3I2+2NO+4H2O | |
| D. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液NH4++Al3++4OH-=NH3↑+Al(OH)3↓+H2O |
18. 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
