题目内容
16.密度为1.45g/ml的H2SO4溶液中,逐滴加入BaCl2溶液,直到SO42-全部沉淀为止,已知沉淀的质量与原来H2SO4溶液的质量相等,则原来H2SO4溶液的浓度为( )| A. | 29.6% | B. | 21% | C. | 6.22 mol/L | D. | 12.4mol/L |
分析 硫酸溶液与氯化钡溶液反应BaCl2+H2SO4═BaSO4↓+2HCl,假设原硫酸溶液的质量,则沉淀硫酸钡质量与原硫酸溶液质量相等,计算出硫酸溶液体积,根据化学方程式计算出硫酸溶液中H2SO4的物质的量,再由c=$\frac{n}{V}$计算.
解答 解:令硫酸溶液的质量为233g,由于硫酸溶液的质量=硫酸钡的质量,则硫酸钡的质量为233g,
所以硫酸溶液体积为$\frac{233g}{1450g/L}$=$\frac{233}{1450}$L
设硫酸溶液中溶质的物质的量为x,则:
BaCl2+H2SO4═BaSO4↓+2HCl
1mol 233g
x 233g
所以,x=1mol,
所以原的硫酸溶液中溶质的物质的量浓度为$\frac{1mol}{\frac{233}{1450}L}$=6.22mol/L,
故选C.
点评 本题考查物质的量浓度有关计算,属于无数据计算类型题,侧重考查学生分析计算能力,采用特殊值来计算即可,题目难度中等.

练习册系列答案
相关题目
3.标准状况下,0.4mol HCl气体的体积是( )
| A. | 22.4L | B. | 11.2L | C. | 4.48L | D. | 8.96L |
11.金属钫(Fr)在自然界中含量极微,它的21个已知同位素都有放射性.它是碱金属元素中最重的元素.根据它在周期表中的位置预言其性质,其中不正确的是( )
| A. | 在已知元素中具有最大的原子半径 | |
| B. | 它是周期表中金属性最强的元素 | |
| C. | 氧化物的水化物的化学式为FrOH,它应是极弱的碱 | |
| D. | 其单质常温下跟水反应比钠剧烈 |
1.下列说法中,正确的是( )
| A. | HCl气体溶于水形成盐酸,存在H+,所以HCl为离子化合物 | |
| B. | 含金属元素的离子一定是阳离子 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 稀有气体原子之间不易形成共价键 |
8.Na2SO3?7H20晶体加热脱水后,强热过程中质量不变.待固体冷却后溶于水,溶液的碱性比Na2SO3溶液强,所得固体成分可能是( )
| A. | Na2S Na2O Na2SO3 | B. | Na2SO4Na2O Na2SO3 | ||
| C. | Na2O Na2S Na2SO4 | D. | Na2S Na2SO3 |
6.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 用含1mol FeCl3的溶液制备成Fe(OH)3胶体,其中胶粒数为NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 常温常压下,14 g CO和N2的混合气体中,含有原子数为NA | |
| D. | 1 L 1 mol/L NH4Cl溶液中含有NH4+数为NA |
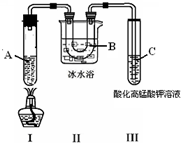 某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
某化学学习小组欲探究己烷的性质,用己烷进行下利实验: