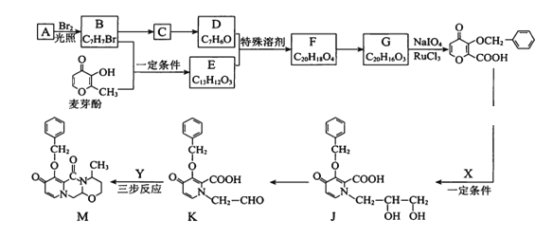
题目内容
【题目】(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为________,这种电池在放电使用一段时间后,电解质溶液中的c(OH-)将____(填“增大”“减小”或“不变”)。
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
锌为____极,该电极上发生_______反应(“氧化”或“还原”),电极反应式为___________,该原电池的总反应离子方程式为_______。

【答案】2H2-4e﹣+4OH﹣=4H2O 减小 负 氧化 Zn-2e-=Zn2+ Zn+Cu2+=Zn2++Cu
【解析】
(1)通入燃料氢气的电极为负极,氢气失去电子变为氢离子,氢离子与溶液中氢氧根离子结合形成水;在正极上氧气得到电子与水结合形成氢氧根离子;根据总反应方程式和c=![]() 计算浓度变化情况;
计算浓度变化情况;
(2)在银锌原电池中,活泼的Zn为负极,失去电子,发生氧化反应;正极上Cu2+得到电子发生还原反应,根据同一闭合回路中电子转移数目相等,将正、负极电极式相加,可得总反应方程式。
(1)在碱性氢氧燃料电池中,通入氢气的电极为负极,H2失去电子变为H+,产生的H+结合碱性溶液中OH-生成H2O,故负极的电极反应式为:2H2-4e-+4OH-=4H2O;通入O2的电极为正极,正极上O2得到电子变为OH-,电极反应式为O2+4e-+2H2O=4OH-。总反应方程式为2H2+O2=2H2O。根据总反应方程式可知:反应产生了水,对溶液中的溶质起稀释作用,导致KOH浓度降低,因此反应后溶液中c(OH-)将减小;
(2)在银锌原电池中,由于金属活动性:Zn>Ag,所以Zn为负极,失去电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+;Ag为正极,正极上溶液中的Cu2+得到电子发生还原反应,正极的电极反应式为Cu2++2e-=Cu,总反应方程式为Zn+Cu2+=Zn2++Cu。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D