题目内容
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成了如下实验:
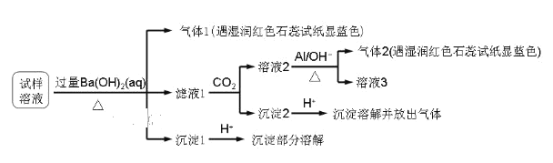
已知:3NO3-+8Al+5OH-+2H2O ![]() 3NH3+8AlO2-
3NH3+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
C.试样中可能存在Na+、Cl-
D.试样中一定不含Al3+
【答案】D
【解析】
试剂加入过量氢氧化钡溶液生成气体1(能使紫色石蕊试纸显蓝色),则气体1为NH3,沉淀1遇酸部分溶解,则必定含SO42-,Mg2+,滤液1通入CO2,溶液2加Al和碱生成氨气,则溶液2含NO3-,沉淀2为BaCO3,可能存在Al3+、Na+、Cl-,必定存在的是NH4+、Mg2+、SO42-、NO3-,以此分析。
试剂加入过量氢氧化钡溶液生成气体1(能使紫色石蕊试纸显蓝色),则气体1为NH3,沉淀1遇酸部分溶解,则必定含SO42-,Mg2+,滤液1通入CO2,溶液2加Al和碱生成氨气,则溶液2含NO3-,沉淀2为BaCO3,可能存在Al3+、Na+、Cl-,必定存在的是NH4+、Mg2+、SO42-、NO3-。
A. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-,故A正确;
B. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4,故B正确;
C. 试样中可能存在Na+、Cl-,故C正确;
D. 试样中可能存在Al3+,故D错误;
故答案选:D。

 综合自测系列答案
综合自测系列答案【题目】用图所示装置检验乙烯时不需要除杂的是
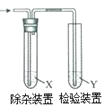
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是

①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快

