题目内容
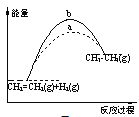
【题目】环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O2![]() 3CO2+4H2O。下列说法中不正确的是( )
3CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1molC3H8和5molO2所具有的总能量大于3molCO2和4molH2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
【答案】A
【解析】
所有发光发热的氧化还原反应都叫做燃烧,燃烧过程中,化学能转化为热能、光能等,一个化学反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小;所有的燃烧反应都是放热反应;丙烷燃烧产物为二氧化碳和水,对环境无污染。
A.火炬燃烧时,不仅发热,而且发光。所以火炬燃烧时,化学能不仅转化为热能,还转化为光能等其它形式的能,故A错误;
B.燃烧反应是指:混合物中的可燃成分急剧与氧反应形成火焰放出大量的热和强烈的光的过程,故B正确;
C.根据能量守恒定律,如果反应物所具有的总能量高于生成物所具有的总能量,在反应中有一部分能量转变为热能的形式释放,这就是放热反应。所有的燃烧反应都是放热反应。丙烷的燃烧是放热反应。所以1molC3H8和5molO2所具有的总能量大于3molCO2和4molH2O所具有的总能量,故C正确;
D.丙烷完全燃烧C3H8+5O2![]() 3CO2+4H2O的产物二氧化碳和水,对环境无污染,丙烷为环保型燃料,故D正确。
3CO2+4H2O的产物二氧化碳和水,对环境无污染,丙烷为环保型燃料,故D正确。
答案选A。

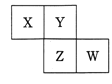
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
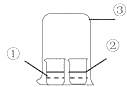
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快