题目内容
某未知溶液中已检验出含大量的Fe2+、SO42— ,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH4+、② SiO32—、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
A.①③⑤ B.②⑤⑥ C.①②⑥ D.③④⑥
B
【解析】 酸性溶液中SiO32—和ClO-与H+不能大量共存,Ca2+与SO42—不能大量共存,选B项。

 名校课堂系列答案
名校课堂系列答案蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 3.3 | 9.4 |
完全沉淀的pH | 3.7 | 5.2 | 11.0 |
实验步骤如下:
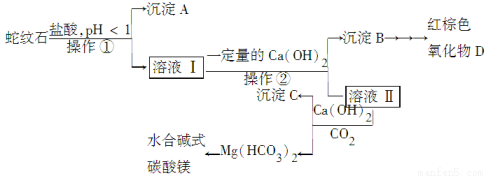
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
单质铜及其化合物一般都具有特殊的颜色,如
Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
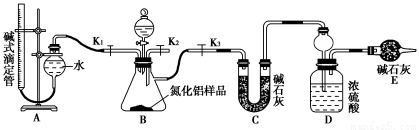
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。

(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管