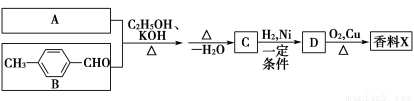
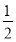题目内容
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式____________________________________________________。
(2)实验装置(如图所示)
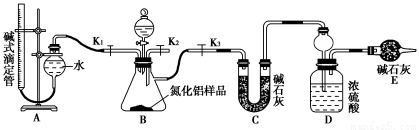
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为a mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞_____________,打开活塞______________,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞_____________,打开活塞_____________,通过分液漏斗加入过量____________(填化学式),与烧瓶内物质充分反应。
④__________________(填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g,
(4)数据分析
①AlN的质量分数为___________________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________________(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为________。(该实验条件下的气体摩尔体积为Vm)。
(1)AlN+NaOH+H2O=NaAlO2+NH3↑
(3)②K2、K3 K1
③K1 K3 NaOH
④打开K2, 通入空气一段时间
(4)①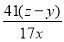 ×100% ②偏小 ③
×100% ②偏小 ③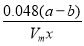 ×100%
×100%
【解析】 (1)AlN与强酸、强碱的反应实质上是AlN先与水发生水解反应,生成Al(OH)3和NH3,生成物然后再分别与强酸或强碱反应。
(2)从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。为了保证生成的氨气全部被吸收,实验装置设计了K2这一活塞和导管,目的就是反应后从此处通入惰性气体将氨气排出被充分吸收。根据氮原子守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;根据碳原子守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案