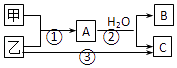
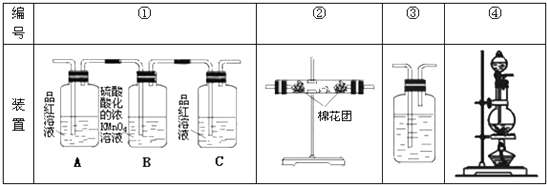
��Ŀ����
����Ŀ������A��B��C��D����Ԫ�أ�AԪ���γɵĩ�2�������ӱȺ�ԭ�ӵĺ����������8����BԪ����AԪ�ؿ����һ�ֻ�����E��Ϊ����ɫ���壬�ù�����������������A�ĵ��ʣ�CΪԭ�Ӻ�����12�����ӵĽ���Ԫ�أ���2.4g C��������ˮ��Ӧʱ���ڱ�״���·ų�����2.24L��C�γ������������ӣ�DԪ��ԭ�ӵ�M������7�����ӣ�
��1��C�����ڱ��е�λ�� ��
��2��D����̬�⻯����H2S��HF���ȶ�����ǿ����Ϊ���û�ѧʽ��ʾ����
��3��д������ɫ����E�ĵ���ʽ �� ���к��еĻ�ѧ��Ϊ ��
��4����Ԫ����BԪ��λ��ͬһ���壬��Ԫ����AԪ�ؿ��γ�K2A��K2A2��KA2�ȶ��ֻ��������K2A2��KA2��CO2���ɷ�����Ӧ����Ӧ�뵭��ɫ����E��CO2�ķ�Ӧ���ƣ���K2A2��KA2��ҽԺ����DZˮ���߿շ����г�������������Ϊ��ά����ѹ�ȶ�����ʹ�ù������غͳ������صĻ����ʹ���յ�CO2�����ɵ�O2�����ͬ��ͬ��ͬѹ���������ǵ����ʵ���֮��Ϊ ��
���𰸡�
��1���������ڢ�A��
��2��HF��HCl��H2S
��3��![]() �����Ӽ������ۼ�
�����Ӽ������ۼ�
��4��1��2
���������⣺������Ԫ���У�AԪ���γɵĩ�2�������ӱȺ�ԭ�ӵĺ����������8������A��������Ϊ8����AΪOԪ�أ�BԪ�ص�һ��������Ϊ����ɫ���壬�ù�����������������A�ĵ��ʣ���BΪNaԪ�أ�CΪԭ�Ӻ�����12�����ӵĶ��۽�������2.4��C��������ˮ��Ӧʱ���ڱ�״���·ų�����2.24L����C�����ԭ������Ϊx���ɵ����غ��֪�� ![]() ��2=
��2= ![]() ��2����x=24����������Ϊ24��12=12����CΪMgԪ�أ�D��M����7�����ӣ���D�ڵ������ڵڢ�A�壬��DΪClԪ�أ���1��CΪMgԪ�أ������ڱ���λ�ã��������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻��2���ǽ�����F��Cl��S�����⻯���ȶ��ԣ�HF��HCl��H2S�����Դ��ǣ�HF��HCl��H2S����3������ɫ����EΪNa2O2 �� ����ʽΪ
��2����x=24����������Ϊ24��12=12����CΪMgԪ�أ�D��M����7�����ӣ���D�ڵ������ڵڢ�A�壬��DΪClԪ�أ���1��CΪMgԪ�أ������ڱ���λ�ã��������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻��2���ǽ�����F��Cl��S�����⻯���ȶ��ԣ�HF��HCl��H2S�����Դ��ǣ�HF��HCl��H2S����3������ɫ����EΪNa2O2 �� ����ʽΪ ![]() ���������Ӽ������ۼ��� ���Դ��ǣ�
���������Ӽ������ۼ��� ���Դ��ǣ� ![]() �����Ӽ������ۼ�����4����KO2Ϊxmol��K2O2Ϊymol����
�����Ӽ������ۼ�����4����KO2Ϊxmol��K2O2Ϊymol����
4KO2+ | 2CO2 | �T | 2K2CO3+ | 3O2 |
4 | 2 | 3 | ||
x |
|
|
2K2O2+ | 2CO2 | �T | 2K2CO3+ | O2 |
2 | 2 | 1 | ||
y | y | 0.5y |
���� ![]() +y=
+y= ![]() x+0.5y��
x+0.5y��
��� y��x=1��2��
���Դ��ǣ�1��2��