题目内容
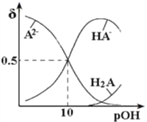
【题目】根据下表数据(数据均为常温下所测数据),判断下列叙述正确的是( )

A. 在等浓度的NaClO、 NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
B. 在等浓度的NaClO、NaHCO3混合溶液中:c(OH-)>c(HClO)>c(H2CO3)
C. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO—=CO32—+2HClO
D. 等温等浓度的NaClO溶液和NaHCO3溶液,前者导电能力强
【答案】B
【解析】A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO3-)+c(H2CO3)+ c(CO32-),选项A错误;B、根据数据右知酸性H2CO3>HClO> HCO3-,则ClO-的水解程度大于HCO3-,则离子浓度大小为c(HCO3-)>c(ClO-)>c(H2CO3),选项B正确;C、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO—=HCO3—+HClO,选项C错误;D、等温等浓度的NaClO溶液和NaHCO3溶液,前者水解程度大,离子浓度小,导电能力弱,选项D错误。答案选B。

练习册系列答案
相关题目