题目内容
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
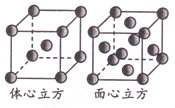
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
【答案】 [Ar]3d6 sp2 sp3 14NA 共价键、离子键、配位键(配位键可以不写) 苯胺分子与水分子间可以形成氢键 2:3
【解析】(1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,则Fe2+核外有24个电子,排布式为[Ar]3d6,答案为:[Ar]3d6
(2)根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键个数+孤电子对,苯胺中碳原子杂化轨道数为3,所以采取sp2杂化,N元素全部形成单键,属于sp3杂化,单键都是σ键,1 mol苯胺分子中含σ键的数目是14NA故答案为:sp2 sp3,14NA
(3)氯化苯胺盐中含有共价键、离子键、配位键,故答案为:共价键、离子键、配位键。
(4)氢键比范德华力强,是一种介于化学键与分子间作用力之间的作用力,含F、O、N元素的物质中分子内或分子之间能形成氢键,苯胺在水中与水形成氢键,而硝基苯与水不能形成氢键,所以苯胺在水中的溶解度远大于硝基苯在水中的溶解度,故答案为:苯胺分子与水分子间可以形成氢键。
(5)体心立方晶胞中每个Fe原子周围有8个Fe原子,面心立方晶胞中,以顶点Fe原子为研究对象,与之最近的Fe原子处于面心,每个Fe原子周围有12个Fe原子,故体心立方晶胞和面心立方晶胞中Fe原子的配位数之比为8:12=2:3,故答案为:2:3.


