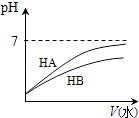
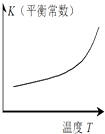
题目内容
【题目】仅根据题中图示得出的结论不合理的是( )
A | B | C | D | |
图示 |
|
|
|
|
结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
A.A
B.B
C.C
D.D
【答案】C
【解析】解:A.加水稀释相同的倍数弱酸的pH变化小,HB溶液的pH变化小,所以HB为弱酸,故A正确;
B.溶液中存在分子,说明HF没有完全电离,即HF为弱酸,故B正确;
C.一定条件下,AgCl可以转化为AgI,但是不能说明AgI的溶解度小于AgCl的溶解度,故C错误;
D.升高温度K增大,说明向正反应方向移动,即正反应方向为吸热方向,所以正反应△H>0,故D正确.
故选C.
【考点精析】根据题目的已知条件,利用反应热和焓变和强电解质和弱电解质的概念和判断的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;强电解质:离子键、强极性键、完全电离;弱电解质:极性键、部分电离.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某研究性学习小组设计了如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
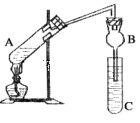
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(1)浓硫酸的作用是________________________________。
(2)球形管B除起冷凝作用外,另一重要作用是____________________________。
(3)反应中所用的乙醇是过量的,其目的是___________________。
(4)C中饱和碳酸钠溶液的作用__________________________________________。
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______________________;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
I.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.l | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.l | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]XCat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和一285.8kJ/mol;
②H2O(l)==H2O(g) △H3=+44.0kJ·mol-1
请回答下列问题(不考虑温度对△H的影响):
(1)反应I在_________(填“低温”或“高温”)下自发进行;反应II每生成9g水蒸气放出热量为___________。
(2)恒容条件下,有利于提高CO2转化为CH3OH的平衡转化率的措施有_____(填字母代号)。
A.延长反应时间 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)由表中实验数据可以得出的结论是_______________________。
(4)553K,使用催化剂Cat.2,在该时刻H2的转化率为______(填字母代号)。
A.5.5% B.13.3% C.16.4% D.29.3%
(5)在下图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。________
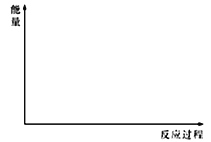
(6)研究证实,CO2也可在硫酸溶液中用情性电解生成甲醇,则生成甲醇的电极反应式是_________,另一极的电解产物为______________________。
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)