题目内容
【题目】已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A. H2O(g) = H2(g) + ![]() O2 (g) △H = +242 kJ/mol
O2 (g) △H = +242 kJ/mol
B. 2H2(g) + O2 (g) = 2H2O (l) △H = -484 kJ/mol
C. H2 (g) + ![]() O2 (g) = H2O (l) △H = -242 kJ/mol
O2 (g) = H2O (l) △H = -242 kJ/mol
D. 2H2 (g) + O2 (g) = 2H2O (g) △H = +484 kJ/mol
【答案】A
【解析】A.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,热化学方程式:H2O(g)═H2(g)+ ![]() O2(g)△H=+242kJmol-1,故A正确;B. 生成水的状态为气态水,不是液态水,故B错误;C.生成水的状态为气态水,不是液态水,故C错误;D.氢气与氧气反应生成气态水为放热反应,焓变值小于0,故D错误;故选A。
O2(g)△H=+242kJmol-1,故A正确;B. 生成水的状态为气态水,不是液态水,故B错误;C.生成水的状态为气态水,不是液态水,故C错误;D.氢气与氧气反应生成气态水为放热反应,焓变值小于0,故D错误;故选A。

【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
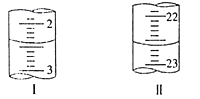
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。



