题目内容
20.俄国化学家门捷列夫为化学的发展做出过十分重要的贡献,在前人研究的基础上,他于1869年提出了( )| A. | 原子学说 | B. | 分子学说 | C. | 等电子体学说 | D. | 元素周期律 |
分析 1869年俄国化学家门捷列夫最先发现元素周期律并绘制第一张元素周期表.
解答 解:A.道尔顿发现了原子,并提出了原子学说,故A错误;
B.意大利科学家阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,故B错误;
C.1919年朗缪尔提出等电子体假说:凡原子数,总电子数均相等的物质,其结构相同,性质相似,相应的物质称为等电子体,故C错误;
D.1869年,俄国科学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确;
故选D.
点评 本题考查有关元素周期律与元素周期表的化学史,题目难度不大,注意识记题干选项中的其它化学史.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 热稳定性:H2O>HF>H2S | |
| B. | NH4Cl的电子式: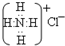 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
15.某同学在探究废干电池内的黑色固体回收利用时,进行如下所示实验:

查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2和石墨粉等物质.请回答以下问题:
(1)操作②玻璃棒的作用是引流;操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、泥三角、坩埚 和三脚架;
(2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(填化学式).
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为MnO2(填化学式).
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:

查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2和石墨粉等物质.请回答以下问题:
(1)操作②玻璃棒的作用是引流;操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、泥三角、坩埚 和三脚架;
(2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(填化学式).
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为MnO2(填化学式).
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
| 2检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ |
5.分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类里,前者属于后者的一组是( )
| A. | 金属,化合物 | B. | 单质,纯净物 | ||
| C. | 石灰乳,胶体 | D. | 过氧化钠,碱性氧化物 |
 ;
;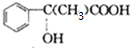 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$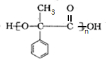 +(n-1)H2O.
+(n-1)H2O.