题目内容
(5分)在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) 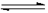 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L, c(H2O) =" 0.03" mol/L, c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
(4) 830℃,在1L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 _____,H2的转化率为 ________。
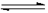 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L, c(H2O) =" 0.03" mol/L, c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
(4) 830℃,在1L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 _____,H2的转化率为 ________。
(1) K=c(CO)·c(H2O)/c(CO2)·c(H2) (2)吸热 (3)小 (4) 1/3, 2/3

试题分析:(1)化学平衡常数:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值。故该反应的化学平衡常数为K =c(CO)·c(H2O)/c(CO2)·c(H2)
(2)随着温度的升高,平衡常数越来越大,说明反应向正反应方向进行,故改反应为吸热反应。
(3)由投放物的浓度可知,相当于多投了H2,故反应向正反应方向进行,H2O的消耗速率比生成速率小。
(4)CO2(g)+H2(g)
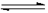 CO(g)+H2O(g)
CO(g)+H2O(g)始态 2 1 0 0
反应 a a a a
终态 2-a 1-a a a
830℃时的平衡常数K=1.0,故得K=a.a/(2-a)(1-a)=1 即a=2/3,故平衡后CO2的转化率为
(2/3)÷2=1/3,H2的转化率为(2/3)÷2=2/3
点评:此题考核了平衡常数的定义及算法,学生只要理解了平衡常数,就能较好的做此类题,难度不大。

练习册系列答案
相关题目
 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,
 W(s)+3 H2O(g)
W(s)+3 H2O(g)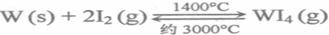
 (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
(CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

 Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):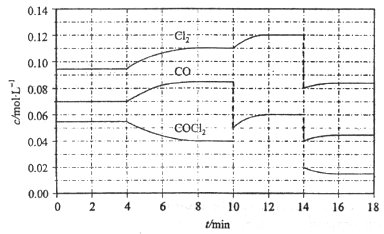
 N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1。