题目内容
I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2?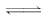 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,
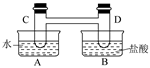
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是
③ 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同)NO2的转化率将 。
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2?
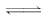 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是
③ 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同)NO2的转化率将 。
I.(1)变浅 (2)0.0767 mol/L 83.7%
Ⅱ.(1)①气体的体积减小,NO2浓度增大,气体的颜色加深
②增大压强,减小气体的体积,平衡向正反应方向移动 ③不变 增大
Ⅱ.(1)①气体的体积减小,NO2浓度增大,气体的颜色加深
②增大压强,减小气体的体积,平衡向正反应方向移动 ③不变 增大
试题分析:I.(1)硝酸铵溶于水吸热,且该反应的正反应是放热反应,所以C中平衡向正反应方向移动,颜色变浅。
(2)达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则消耗NO2的浓度是0.032 1 mol/L×2=0.0642 mol/L,所以NO2的起始浓度是0.012 5 mol/L+0.0642 mol/L=0.0767 mol/L。则NO2的转化率为
 。
。Ⅱ.(1)①气体的体积减小,因此NO2浓度增大,所以气体的颜色加深。
②增大压强,减小气体的体积,平衡向正反应方向移动,因此一段时间后气体颜色又变浅。
③平衡常数只与温度有关系,所以改变压强,平衡常数不变;平衡向正反应方向移动,所以反应物的转化率增大。
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题有利于培养学生的逻辑思维能力和发散思维能力,有助于培养学生分析问题、解决问题的能力。

练习册系列答案
相关题目
 CO2(g)+H2(g)下列情况中,能说明反应达到化学平衡状态的是
CO2(g)+H2(g)下列情况中,能说明反应达到化学平衡状态的是 2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是:( )
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是:( )
 2NH3,下列说法正确的是
2NH3,下列说法正确的是 2N2(g)+3H2O(g) ΔH<0
2N2(g)+3H2O(g) ΔH<0 2NH3(g),若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中正确的是
2NH3(g),若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中正确的是

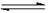 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: