题目内容
(14分)针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是 ;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是: ;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式: 。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
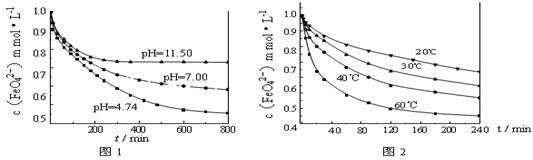
[实验2]将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是 ;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是: ;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式: 。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。

[实验2]将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O
 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。(14分)(1)先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色(2分)
硫氰根被氧化(2分) 2H2O2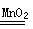 2H2O+O2↑(2分必须注明催化剂)
2H2O+O2↑(2分必须注明催化剂)
(2)2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+ (2分)
(3)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率)(2分)
②温度越高,FeO42-越不稳定(或与水反应的速率越快)(2分)
③pH=11.50的溶液中OH—离子浓度大,使平衡向左移动 (2分)
硫氰根被氧化(2分) 2H2O2
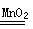 2H2O+O2↑(2分必须注明催化剂)
2H2O+O2↑(2分必须注明催化剂)(2)2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+ (2分)
(3)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率)(2分)
②温度越高,FeO42-越不稳定(或与水反应的速率越快)(2分)
③pH=11.50的溶液中OH—离子浓度大,使平衡向左移动 (2分)
(1)亚铁离子具有还原性,据此可以鉴别,微粒排除铁离子的干扰,有关首先加热KSCN溶液,即先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;由于硫氰根也极易被氧化,所以在实验中往往又看到血红色迅速褪去;双氧水不稳定,易分解生成氧气,反应的方程式是2H2O2 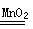 2H2O+O2↑。
2H2O+O2↑。
(2)根据反应物和生成物可以写出该反应的方程式为2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+。
(3)①实验①中不同的是溶液的pH值,所以实验目的是探究FeO42-在不同pH溶液中的稳定性(或反应的速率)。
②根据图②可知,温度越高,FeO42-的浓度越低,说明升高温度,FeO42-越不稳定(或与水反应的速率越快)。
③pH=11.50的溶液中OH—离子浓度大,根据勒夏特列原理可知,增大OH-的浓度平衡向逆反应方向移动,所以pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高。
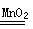 2H2O+O2↑。
2H2O+O2↑。(2)根据反应物和生成物可以写出该反应的方程式为2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+。
(3)①实验①中不同的是溶液的pH值,所以实验目的是探究FeO42-在不同pH溶液中的稳定性(或反应的速率)。
②根据图②可知,温度越高,FeO42-的浓度越低,说明升高温度,FeO42-越不稳定(或与水反应的速率越快)。
③pH=11.50的溶液中OH—离子浓度大,根据勒夏特列原理可知,增大OH-的浓度平衡向逆反应方向移动,所以pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高。

练习册系列答案
相关题目

 过滤
过滤 洗涤
洗涤 过滤
过滤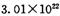 个 B原混合物:
个 B原混合物: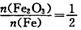
 D .所得溶液:
D .所得溶液: