题目内容
已知有以下物质相互转化
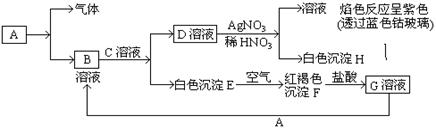
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的实验现象是 ;向G溶液加入A的有关离子反应方程式 。

试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的实验现象是 ;向G溶液加入A的有关离子反应方程式 。
(1)FeCl2 KCl (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)出现血红色溶液 2Fe3++Fe=3Fe2+
(3)出现血红色溶液 2Fe3++Fe=3Fe2+
试题分析:红褐色沉淀F是氢氧化铁、E为氢氧化亚铁、G为氯化铁;D溶液与硝酸银溶液生成白色沉淀H为氯化银,滤液焰色反应呈紫色(透过蓝色钴玻璃)说明滤液中含有K+,所以D为KCl,逆推B和C应为氯化亚铁和氢氧化钾,FeCl3溶液与A生成B溶液,所以B为氯化亚铁,A为铁。检验氯化铁溶液中Fe3+用KSCN溶液,氯化铁溶液中加入铁生成氯化亚铁溶液。
点评:无机推断题要找准题眼,如本题中的红褐色沉淀为氢氧化铁、白色沉淀在空气中转化为氢氧化铁的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
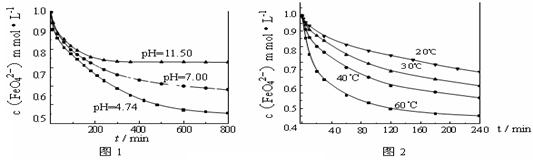
 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。