题目内容
(12分)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
| 编号 | 实验操作 | 实验主要现象 | 离子方程式 |
| | | 铁粉部分溶解,溶液有棕黄色变浅绿色 | 2Fe3++Fe=3Fe2+ |
| | | 生成红褐色沉淀并放出无色无味气体 | 2Na2O2+2H2O=4Na++4OH-+O2↑ Fe3++3OH—=Fe(OH)3↓ |
| | | 生成白色沉淀 | Ag++Cl-=AgCl↓ |
试题分析:氯化铁溶液呈黄色,向其中加入过量铁粉生成氯化亚铁溶液,溶液呈浅绿色,离子方程式为2Fe3++Fe=3Fe2+。
过氧化钠与水生成氢氧化钠和氧气,氢氧化钠与氯化铁生成红褐色沉淀,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑、Fe3++3OH—=Fe(OH)3↓。
氯化铁与硝酸银生成白色沉淀,离子方程式为Ag++Cl-=AgCl↓。
点评:向溶液中加过氧化钠时,可认为过氧化钠先与水反应,生成的氢氧化钠再与溶液中溶质反应。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
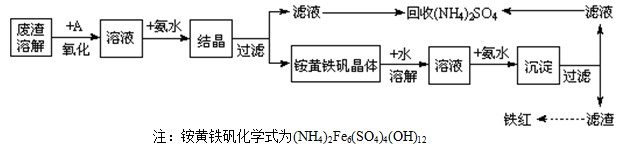
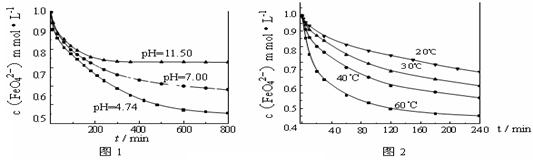
 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。