题目内容
铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为 ,该反应中氧化剂为________ .
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为 ,该反应中氧化剂为________ .
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________
(1)Cu2S + O2 =2Cu + SO2 O2 ,.Cu2O (2)0.9
(3) X Fe Y HCl Z Cl2 2Fe 2+ + Cl2 == 2Fe 3+ + 2Cl-
(3) X Fe Y HCl Z Cl2 2Fe 2+ + Cl2 == 2Fe 3+ + 2Cl-
(1)根据物质的组成可知,生成物除铜以外,还与SO2生成,所以反应的方程式是Cu2S + O2 =2Cu + SO2;根据方程式可知,氧元素和铜元素的化合价都是降低的,所以氧化剂是O2和Cu2O。
(2)由于在反应过程中,硫酸的浓度逐渐降低,而稀硫酸和铜是不反应的,所以被还原的硫酸小于0.9mol。
(3)溶液中还原氯化铜、氯化铁、氯化亚铁,所以首先加入足量的铁粉置换出铜,即X是铁。由于铁过量,所以在金属混合物中加入盐酸溶解铁,过滤、洗涤干燥即得到铜,因此Y是盐酸。要把氯化亚铁变成氯化铁,则需要通入氯气,则Z是氯气,反应的离子方程式是2Fe 2+ + Cl2 ="=" 2Fe 3+ + 2Cl-。
(2)由于在反应过程中,硫酸的浓度逐渐降低,而稀硫酸和铜是不反应的,所以被还原的硫酸小于0.9mol。
(3)溶液中还原氯化铜、氯化铁、氯化亚铁,所以首先加入足量的铁粉置换出铜,即X是铁。由于铁过量,所以在金属混合物中加入盐酸溶解铁,过滤、洗涤干燥即得到铜,因此Y是盐酸。要把氯化亚铁变成氯化铁,则需要通入氯气,则Z是氯气,反应的离子方程式是2Fe 2+ + Cl2 ="=" 2Fe 3+ + 2Cl-。

练习册系列答案
相关题目
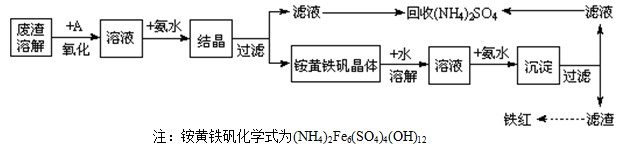

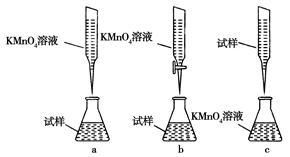
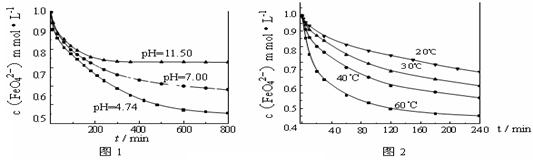
 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,