题目内容
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
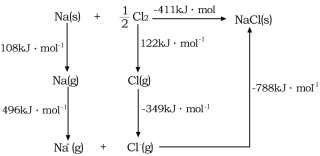
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
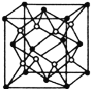
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
【答案】![]() 球 BC 乙炔钠是离子晶体,
球 BC 乙炔钠是离子晶体,![]() 是分子晶体 直线形
是分子晶体 直线形 ![]()
![]()
![]() 349 788
349 788 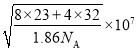
【解析】
(1)基态S原子是16号原子,它的价电子轨道表示式为![]() ;Na的最高能级为3s能级,电子云模型为球形;
;Na的最高能级为3s能级,电子云模型为球形;
(2)乙炔钠是一种有机金属化合物,结构中存在离子键、σ键和π键,乙炔钠的熔沸点比S8高,原因是乙炔钠是离子晶体,S8是分子晶体;
(3)根据VSEPR模型计算,中心原子不存在孤电子对,因此N3-为直线型分子,中心N原子的杂化方式为sp杂化;
(4)根据Born—Haber循环可以得到,Na原子的电子电离能为气态基态电中性原子失去电子所吸收的能量为496 kJ·mol-1,Cl-Cl的键能为1molCl2断开化学键所吸收的能量为244 kJ·mol-1,Cl的电子亲和能为Cl-得到电子变成Cl所放出的能量为349 kJ·mol-1,NaCl的晶格能为Na+和Cl-形成稳定氧化物所放出的能量为788 kJ·mol-1;
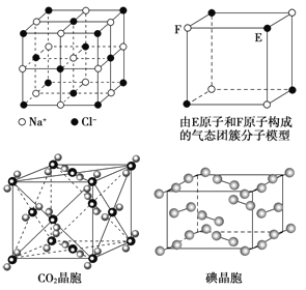
(5)从晶胞结构中可以看出Na在晶胞的体心,S在晶胞的顶点和面心上,一个晶胞中4个Na2S,由此可以算出晶胞参数为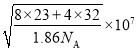 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如图:
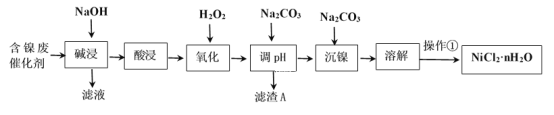
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Al的原子结构示意图为___。
(2)“酸浸”、“溶解”所使用的酸为___。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至___为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。