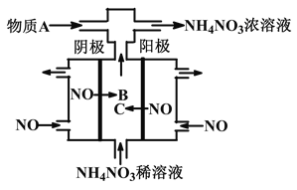
题目内容
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
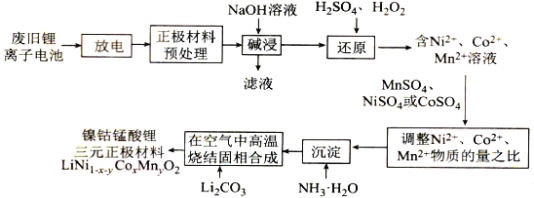
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
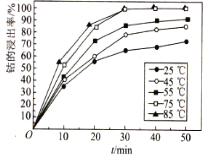
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
【答案】放电有利于Li+向正极移动并进入正极材料 粉碎、适当增大NaOH的浓度、适当升高温度等 2Al+2H2O+2OH-=2AlO2-+3H2↑ 沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次 2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑ 75℃,30 min 9.3
【解析】
(1)放电过程中,Li+向正极移动;
(2)根据影响速率的因素分析;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)根据实验基本操作“洗涤”回答;
(5)LiCoO2参与“还原”反应中LiCoO2被H2O2还原为Co2+;
(6)根据图示,75℃,85℃,30 min 浸出率都能达到接近100%;
(7)根据Ksp[Co(OH)2]=4.0×10-15计算Co2+离子沉淀完全时c(OH-)。
(1). 放电有利于Li+向正极移动并进入正极材料,所以进行“放电处理”有利于锂在正极的回收;
(2)粉碎、适当增大NaOH的浓度、适当升高温度等,能够提高“碱浸”效率;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4). 洗涤的操作过程:沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
(5)LiCoO2参与“还原”反应中LiCoO2被H2O2还原为Co2+,反应的离子方程式是2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑;
(6)根据图示,75℃和85℃,30 min 浸出率都能达到接近100%,75℃消耗能量少,所以浸出过程的最佳条件是75℃,30min;
(7)Ksp[Co(OH)2]=4.0×10-15,Co2+离子沉淀完全时c(OH-)=![]() ,c(OH-)=
,c(OH-)=![]() ,所以pH=9.3。
,所以pH=9.3。

 精英口算卡系列答案
精英口算卡系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
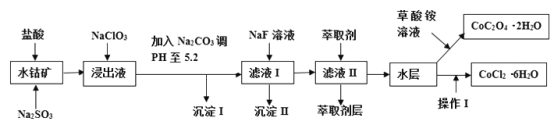
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。