题目内容
8.下列排序不正确的是( )| A. | 还原性:HI>HBr>HCl>HF | |
| B. | 晶体熔点:金刚石>SiC>NaCl>Na>Mg>Al | |
| C. | 酸性:HClO4>H2SO4>H2SO3>HClO | |
| D. | 晶格能:MgF2>NaCl>NaBr |
分析 A、元素非金属性越强,其气态氢化物还原性越弱;
B、不同晶体类型物质熔点一般情况下,原子晶体熔点最高,其次为离子晶体;影响原子晶体硬度大小的因素是共价键的键长;影响金属晶体金属键强弱的因素为电荷和离子半径;
C、元素非金属性越强,其最高价氧化物对应水化物酸性越强;同一元素最高价含氧酸酸性最强;酸性强弱顺序为H2SO3>H2CO3>HClO;
D、离子半径越小,所带电荷数越多,晶格能越大.
解答 解:A、元素非金属性F>Cl>Br>I,所以气态氢化物还原性由强到弱为HI>HBr>HCl>HF,故A正确;
B、Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故B错误;
C、元素非金属性Cl>S,酸性HClO4>H2SO4,由于同一元素最高价含氧酸酸性最强,所以H2SO4>H2SO3,酸性强弱顺序为H2SO3>H2CO3>HClO,故C正确;
D、先比较电荷数多的晶格能大,而如果电荷数一样多比较核间距,核间距大的,晶格能小,故D正确.
故选:B.
点评 本题考查熔沸点、非金属和金属性、酸性以及晶格能的比较,明确常见的比较的方法是解答本题的关键,注意知识的归纳整理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某化学反应:A(g)?B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是( )


| A. | 0~50秒,A物质化学反应速率v(A)=0.0016mo 1•L-1•S-1 | |
| B. | 250s时该反应达到化学平衡状态 | |
| C. | 若改加入2.0mol A,A的平衡转化率大于20% | |
| D. | 300K时,该反应的平衡常数为0.025 mol•L-1 |
13.将Ca(OH)2加入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).下列说法中正确的是( )
| A. | 恒温下向溶液中加CaO,溶液的pH升高 | |
| B. | 给溶液加热,溶液的pH升高 | |
| C. | 恒温下向溶液中加入CaO后,溶液中的c(OH-)不变 | |
| D. | 向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变 |
20. 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )| A. | 石墨Ⅱ电极为正极 | |
| B. | Y为N2O5 | |
| C. | 石墨Ⅰ电极方程式为NO+O2--2e-=NO2 | |
| D. | 不能用NaNO3水溶液代替熔融NaNO3 |
17.下列关于同系物的说法中,错误的是( )
| A. | 同系物具有相同的最简式 | |
| B. | 同系物之间相对分子质量相差14或14的整数倍 | |
| C. | 同系物符合同一通式 | |
| D. | 同系物的化学性质基本相似,物理性质随碳原子数的增加呈规律性变化 |
 硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.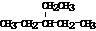 .
.