题目内容
4.142g Na2SO4中比126g Na2SO3多1mol O,将上述Na2SO4和Na2SO3混合,所得混合物中Na+的物质的量为4mol,S元素在混合物中的质量分数为23.9%.分析 Na2SO4中比Na2SO3多1个O原子,n(Na2SO4)=$\frac{142g}{142g/mol}$=1mol,1molNa2SO4中比1molNa2SO3多1molO原子,根据m=nM计算m(Na2SO3);
根据钠离子守恒得n(Na+)=2n(Na2SO4)+2n(Na2SO3);
先计算S元素质量,再根据质量分数=$\frac{m(S)}{混合物质量}×100%$进行计算.
解答 解:Na2SO4中比Na2SO3多1个O原子,n(Na2SO4)=$\frac{142g}{142g/mol}$=1mol,1molNa2SO4中比1molNa2SO3多1molO原子,m(Na2SO3)=1mol×126g/mol=126g;
根据钠离子守恒得n(Na+)=2n(Na2SO4)+2n(Na2SO3)=2mol+2mol=4mol;
根据S原子守恒得n(S)=n(Na2SO4)+n(Na2SO3)=1mol+1mol=2mol,S元素质量分数=$\frac{m(S)}{混合物质量}×100%$=$\frac{2mol×32g/mol}{142g+126g}×100%$=23.9%,
故答案为:126;4;23.9%.
点评 本题考查物质的量有关计算,为高频考点,明确化学式中各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,侧重考查分析计算能力,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
9.由氧化铜、氧化铁组成的混合物ag,加入2mol•L-1的硫酸50mL时固体恰好完全溶解.若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量减少为( )
| A. | 1.6g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
13.下列说法正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 在标准状况下,等质量的氮气和一氧化碳的体积不相等 | |
| C. | 任何条件下,等物质的量的CH4和CO所含的分子数必相等 | |
| D. | 1L一氧化碳气体一定比1L氧气的质量小 |
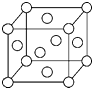 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题: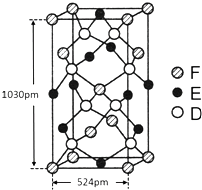 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: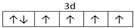 ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
;
 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040mol•L-1,放出热量Q1kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040mol•L-1,放出热量Q1kJ.