题目内容
【题目】当实验出现某种现象时,即可判定该步实验操作已完成。下列实验中出现结束该步操作的现象正确的是
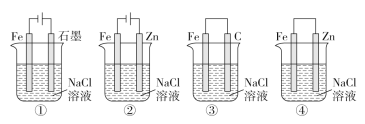
A.“镀锌铁皮锌镀层厚度的测定”:铁皮在稀硫酸溶液中不再产生气泡
B.“食醋总酸含量的测定”:滴入NaOH标准溶液,锥形瓶内溶液恰好呈浅红色
C.“乙酸乙酯碱性条件下水解”:NaOH溶液上层的油层消失
D.“硫酸亚铁铵的制备”:蒸发![]() 和
和![]() 混合溶液,出现大量晶体
混合溶液,出现大量晶体
【答案】C
【解析】
A.锌和铁均能与稀硫酸反应,故当锌和稀硫酸反应后铁皮能继续在稀硫酸溶液中反应,不会出现不再产生气泡的情况,故A错误;
B.醋酸钠溶液显碱性,故当锥形瓶内恰好出现浅红色时,此时的仍是稍过量,两者并没有恰好反应完全,故测量的醋酸的浓度偏低,故B错误;
C.乙酸乙酯在碱性条件下生成乙酸钠和乙醇,两者均溶于水,故当油层消失时,说明乙酸乙酯已水解完全,故C正确;
D.蒸发FeSO4和(NH4)SO4混合溶液时,Fe2+易被氧化,故蒸发FeSO4和(NH4)SO4混合溶液得不到硫酸亚铁铵,故D错误。
故选:C。

【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①![]()
![]()
②![]()
![]()
③断裂![]() 气体中的化学键需要吸收1076kJ的能量,断裂
气体中的化学键需要吸收1076kJ的能量,断裂![]() 气体中的化学键需要吸收1490kJ的能量。
气体中的化学键需要吸收1490kJ的能量。
请回答:
(1)断裂![]() 中所有化学键需要吸收的能量为________kJ。
中所有化学键需要吸收的能量为________kJ。
(2)T1℃时,向密闭容器中加入一定量的![]() 和C,发生反应①,达到平衡后
和C,发生反应①,达到平衡后![]() 的浓度为
的浓度为![]() ;其他条件不变,缩小容器体积,再次达到平衡时,
;其他条件不变,缩小容器体积,再次达到平衡时,![]() 的浓度为
的浓度为![]() ,则a________b(选填“>”“<”或“=”)。
,则a________b(选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的![]() 和CO发生反应②,测得相关数据如表所示:
和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
|
|
| |||
1 | 恒温 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒温 | 2 | 3 | M | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1=_______。
②容器2中,5min达到平衡,则0~5min以![]() 表示该反应的速率
表示该反应的速率![]() ___________。
___________。
③对于三个容器中的反应,下列说法正确的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡转化率
的平衡转化率![]()
C.![]() D.平衡时气体压强:
D.平衡时气体压强:![]()
(4)一定条件下,向恒压密闭容器中充入0.5mol ![]() 和1.0mol CO,发生反应②,CO和
和1.0mol CO,发生反应②,CO和![]() 的物质的量浓度(c)与时间(t)的关系如图所示:
的物质的量浓度(c)与时间(t)的关系如图所示:

①6min时改变的外界条件为________________。
②若在6min时,恒温将容器体积扩大到10L,请在图中画出6~10min![]() 的物质的量浓度随时间变化的曲线_________。
的物质的量浓度随时间变化的曲线_________。