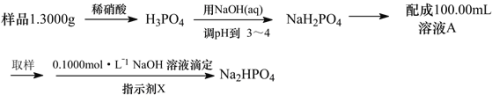题目内容
【题目】某化合物的分子式为![]() ,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为
,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为![]() 和
和![]() ,已知
,已知![]() 分子的键角为
分子的键角为![]() 。下列推断不正确的是
。下列推断不正确的是 ![]()
![]()
A.![]() 分子的空间构型为V形
分子的空间构型为V形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 分子中A原子采取
分子中A原子采取![]() 杂化
杂化
D.![]() 分子中无H原子,分子间不能形成氢键
分子中无H原子,分子间不能形成氢键
【答案】B
【解析】
A.A属于第ⅥA族元素,最外层有6个电子,与B形成2个![]() 单键,含有2对孤电子对,故A原子采取
单键,含有2对孤电子对,故A原子采取![]() 杂化,
杂化,![]() 分子的键角为
分子的键角为![]() ,VSEPR模型为四面体,减去孤对电子,分子的立体构型为 “V”形,故A正确;
,VSEPR模型为四面体,减去孤对电子,分子的立体构型为 “V”形,故A正确;
B.由电负性可知,B元素的非金属性更强,![]() 键为极性共价键,且分子构型为V形,正、负电荷中心不重合,故AB2分子为极性分子,B错误;
键为极性共价键,且分子构型为V形,正、负电荷中心不重合,故AB2分子为极性分子,B错误;
C.A属于第ⅥA族元素,最外层有6个电子,与B形成2个![]() 单键,含有2对孤电子对,故A原子采取
单键,含有2对孤电子对,故A原子采取![]() 杂化,故C正确;
杂化,故C正确;
D.A属于第ⅥA族元素,B属于第ⅦA族元素,![]() 分子中不可能含有H原子,分子间不能形成氢键,故D正确;
分子中不可能含有H原子,分子间不能形成氢键,故D正确;
答案选B。

练习册系列答案
相关题目
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
(B中试剂为浓盐酸、碳酸钠溶液、硅酸钠溶液)
A.AB.BC.CD.D