题目内容
【题目】NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为_____。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为____。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
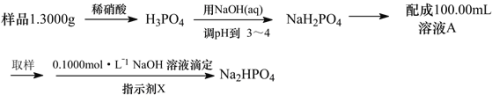
①NaOH标准溶液应盛放在如图所示的滴定管___(选填“甲”或“乙”)中。

②滴定时所用的指示剂X可为____,判断滴定终点的方法是___。
③下列操作会导致测定结果偏低的是____
A.碱式滴定管未润洗
B.锥形瓶用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
【答案】H2PO4-HPO42-+H+ HPO42-+H2OH2PO4-+OH- 乙 酚酞 滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不变化 C
【解析】
(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度;
(3)①碱性溶液用碱式滴定管量取;
②NaH2PO4溶液显弱碱性,应选用碱性范围内变色的酚酞作指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
③根据c(待测)= 判断不当操作对相关物理量的影响;
判断不当操作对相关物理量的影响;
(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度,该阴离子电离方程式为H2PO4-HPO42-+H+,
故答案为:H2PO4-HPO42-+H+;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度,该阴离子水解方程式为HPO42-+H2OH2PO4-+OH-,
故答案为:HPO42-+H2OH2PO4-+OH-;
(3)①NaOH标准溶液应盛放在如图所示的滴定管,
故答案为:乙;
②NaH2PO4溶液显弱酸性,应选用碱性范围内变色的酚酞作指示剂,滴定终点时颜色变化明显;用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不变化;
③A. 碱式滴定管未润洗,标准液被稀释,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故A错误;
分析,c(待测)偏大,故A错误;
B. 锥形瓶用待测液润洗,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故B错误;
分析,c(待测)偏大,故B错误;
C. 读取标准液读数时,滴定前仰视,滴定到终点后俯视,造成V(标准)偏小,根据c(待测)= 分析,c(待测)偏小,故C正确;
分析,c(待测)偏小,故C正确;
D. 滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故D错误;
分析,c(待测)偏大,故D错误;
故答案选C。

【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2