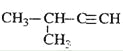题目内容
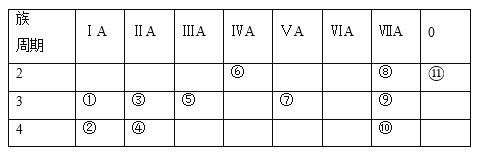
【题目】如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3![]() K2S4+3KI。装置(2)为电解池的示意图。当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
K2S4+3KI。装置(2)为电解池的示意图。当闭合开关K时,X附近溶液先变红,下列说法正确的是( )

A.K+从右到左通过离子交换膜
B.电极M的反应式:I3﹣+2e﹣=3I﹣
C.电极X的反应式:4OH﹣﹣4e﹣═O2↑+2H2O
D.当电极Y有0.2mole﹣转移时,产生0.1molCl2
【答案】D
【解析】
当闭合开关K时,(2)为电解池,(1)为原电池,X附近溶液先变红,说明X电极是阴极、Y电极是阳极,则M是负极、N是正极。
A.放电时,钾离子向正极N电极移动,即K+从左到右通过离子交换膜到N电极,故A错误;
B.M电极上I-失电子发生氧化反应,电极反应式为3I--2e-=I3-,故B错误;
C.X电极上水得电子生成氢气同时生成氢氧根离子,电极反应式为2H2O+2e﹣═H2↑+2OH﹣,故C错误;
D.Y电极反应式为2Cl﹣﹣2e﹣=Cl2↑,根据转移电子与氯气之间的关系知,当有0.2mol电子转移时n(Cl2)=0.1mol,故D正确;
故选:D。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目