题目内容
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法错误的是( )
| A.溶液中导电粒子的数目增加 |
B.溶液中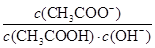 不变 不变 |
| C.醋酸的电离程度增大,但电离平衡常数Ka不变 |
| D.再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
D
试题分析:在醋酸溶液存在电离平衡:CH3COOH
 CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O
CH3COO-+H+ A。若加入水,则c(CH3COO-)、c(CH3COOH)、c(H+)的浓度都减小。由于电离产生的离子的浓度减小的多,所以电离平衡正向移动。所以溶液中导电粒子的数目增加。正确。B。因此c(CH3COOH)减小的倍数大于c(CH3COO-)或c(H+)减小的倍数。在溶液中还存在水的大量平衡:H2O H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中
H++OH-。在溶液中存在水的离子积常数,它只与温度有关,而与浓度等无关。因此c(H+)·c(OH-)=Kw.c(H+)减小的倍数与c(OH-)增大的倍数相同。所以溶液中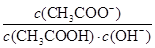 不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
不变。正确。C.加水稀释,电离平衡正向移动,醋酸的电离程度增大,但由于温度不变,所以电离平衡常数Ka不变。正确。D.醋酸是弱酸部分电离。c(CH3COOH)>> c(H+)=10-3mol/L.若再加入10 mL pH=11的NaOH溶液,将电离的部分完全中和,由于在溶液中还存在电离未电离的电解质分子,所以破坏了醋酸的电离,平衡,醋酸会减小电离直至达到新的平衡。错误。
练习册系列答案
相关题目
 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是 NH
NH +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )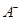 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。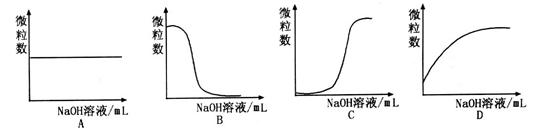
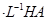 溶液和1体积0.02mol
溶液和1体积0.02mol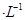 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。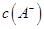 0.01 mol
0.01 mol