题目内容
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3·H2O混合溶液中c(Cl-)>c(NH4+) |
| B.pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的1 0倍 |
| C.AgCl在0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的溶解度相同 |
| D.1 mL l mol l L Na2CO3溶液加水稀释至100 mL,pH和Kw均减小 |
B
试题分析:A、pH=9的NH4Cl与NH3·H2O混合溶液中NH3·H2O的电离程度大于NH4Cl的水解程度,所以c(Cl-)<c(NH4+),错误;B、pH=2.5的可乐中c(H+)=1×10-2.5mol/L,pH=3.5的柠檬水中c(H+)=1×10-3.5mol/L,前者是后者的10倍,正确;C、0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的氯离子的浓度不同,导致AgCl的溶解度不同,错误;D、Kw是温度常数,温度不变,Kw不变,错误,答案选B。w的判断,同一物质在不同溶剂中的溶解度的判断

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
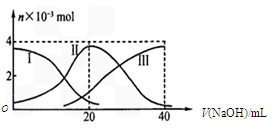
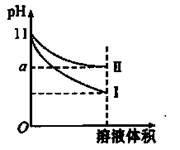
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )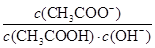 不变
不变 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )