题目内容
2. 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:(1)煤的主要成分为碳氢化合物,若用CH代表煤的“分子式”,写出煤与水蒸气生成水煤气的化学方程式:2CH+2H2O(g)$\stackrel{高温}{→}$2CO+3H2.
(2)已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)=2CO(g)+H2(g)△H1
气化后的气体合成甲醇 CO(g)+2H2(g)=CH3OH(g)△H2
甲醇制备丙烯的反应 3CH3OH(g)=C3H6(g)+3H2O(g)△H3
则煤在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式为12CH(s)+6O2(g)═C3H6(g)+3H2O(g)+9CO(g)△H=6△H1+3△H2+△H3.
(3)科研小组利用某恒容密闭容器进行CO和H2合成甲醇的探究.若容器容积为VL,加入CO和H2的物质的量之比为1:2,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g)
如图为反应达到平衡时CO的转化率与温度、压强的关系:
①上述CO和H2合成甲醇的反应为放热(填“放热”或“吸热”)反应,图象中压强( pl,p2,p3)的大小顺序为P1<P2<P3.
②温度为100℃时,加入n mol CO与2n mo1H2,达到平衡时压强为pl,则该反应的平衡常数K=$\frac{{V}^{2}}{{n}^{2}}$(用含n、V的式子表示);在温度不变的条件下,向该容器中再加人n mol CO与2n mo1H2,再次达到平衡时,CO的转化率增大(填“增大”、“减小”或“不变”).
③如果要提高CO的转化率,除改变温度、压强外,还可以采取的措施有加入氢气、分离出产物甲醇.
分析 (1)根据原子守恒法书写反应的化学方程式;
(2)根据盖斯定律进行计算,书写热化学方程式;
(3)①从图中可以分析得到温度越高,CO的转化率降低;
在相同的温度时,压强越大,CO转化率越大;
②根据平衡三段式计算出平衡时各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
在温度不变的条件下,向该容器中再加人nmolCO与2n mo1H2,相当增大压强,平衡向气体分子数减小的方向移动;
③提高CO的转化率,即平衡正向移动,可采取的措施有:增大另一只反应物的浓度、减小生成物浓度等.
解答 解:(1)煤与水蒸气生成水煤气的化学方程式为:2CH+2H2O(g)$\stackrel{高温}{→}$ 2CO+3H2,
故答案为:2CH+2H2O(g)$\stackrel{高温}{→}$ 2CO+3H2;
(2)①2CH(s)+O2(g)=2CO(g)+H2(g)△H1
②CO(g)+2H2(g)=CH3OH(g)△H2
③3CH3OH(g)=C3H6(g)+3H2O(g)△H3
①×6+②×3+③得,12CH(s)+6O2(g)═C3H6(g)+3H2O(g)+9CO(g)△H=6△H1+3△H2+△H3,
故答案为:12CH(s)+6O2(g)═C3H6(g)+3H2O(g)+9CO(g)△H=6△H1+3△H2+△H3;
(3)①从图中可以分析得到温度越高,CO的转化率降低,平衡逆向移动,故正反应方向是放热的;
在相同的温度时,CO的转化率不同,压强越大转化率越大,故P1<P2<P3;
故答案为:放热,P1<P2<P3;
②容器容积为VL,反应压强为pl时CO的转化率为0.5,
CO(g)+2H2(g)?CH3OH(g)
起始时 n mol 2n mo1
转化 0.5n mol n mo1 0.5n mol
平衡时 0.5n mol n mo1 0.5n mol
c(CH3OH)=$\frac{0.5n}{V}$mol/L,c(H2)=$\frac{n}{V}$mol/L,c(CO)=$\frac{0.5n}{V}$mol/L,
故平衡常数K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$=$\frac{\frac{0.5n}{V}}{\frac{n}{V}×\frac{n}{V}×\frac{0.5n}{V}}$=$\frac{{V}^{2}}{{n}^{2}}$,
在温度不变的条件下,向该容器中再加人nmolCO与2nmo1H2,相当于在原有的基础上把容器的体积缩小为原来的一半,压强增大,平衡正向移动,反应物CO的转化率增大,
故答案为:$\frac{{V}^{2}}{{n}^{2}}$,增大;
③提高CO的转化率,即平衡正向移动,可采取的措施有:加入氢气、分离出产物甲醇等,
故答案为:加入氢气、分离出产物甲醇.
点评 本题考查化学方程式的书写、盖斯定律的应用、化学平衡移动原理及平衡常数的计算等,浓度中等.要注意平衡三段式的运用是解题的关键.

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案下列说法不正确的是( )

| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |
| A. | 18 | B. | 16 | C. | 8 | D. | 6 |
某品牌食醋,在实验室中进行食醋中醋酸含量的定量测定实验.
实验原理:用已知浓度的氢氧化钠溶液和醋酸反应.
(1)因食醋有颜色,可能干扰中和滴定时对指示剂颜色的观察,所以须先脱色,但又不能影响醋酸含量的测定,下列所加脱色剂适宜的是C
(填序号). A、氯水 B、Na2O2C、活性炭 D、SO2
(2)用酸式(填“酸式”或“碱式”)滴定管取步骤(1)所得的食醋20.00mL,加入到一洁净的锥形瓶中,并滴加2滴酚酞作指示剂.
(3)用0.5000mol•L-1氢氧化钠溶液进行滴定,并重复滴定操作两次.某同学的实验数据记录如下表:
| 食醋的体积/mL | 所用氢氧化钠溶液的体积/mL | |
| 第一次 | 20.00 | 19.8 |
| 第二次 | 20.00 | 21.2 |
| 第三次 | 20.00 | 19.7 |
无影响(填“有影响”或“无影响”),为什么?稀释过程中溶质物质的量不变,消耗的NaOH物质的量不变.
(5)老师在审核了这一表格后指出,所记录的数据有一明显失误,此失误是滴定管的读数在小数点后没有保留两位.实验操作中也存在着失误,在计算时应舍去这一组数据,这一组是第二次滴定的数据.
(6)请以表格中的数据通过计算后说明该食醋是否符合国家标准?不符合(填“符合”或“不符合”).
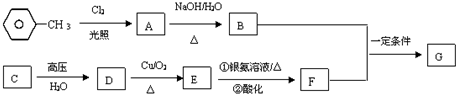
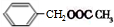 .
.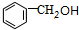 +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ .
.
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.